Preprint
THE THIRD CONCEPT OF AGING OF METAZOA
Olexiy Boyko,
an independent researcher; Lubny, Poltava region, 37506, Ukraine.
Send correspondence to Olexiy Boyko, Email: boyko.lubny@gmail.com
26 December 2014
ABSTRACT
This paper offers the third concept of aging phenomenon in the history of the biology of aging afterwards both programmed and stochastic concepts. For the first time in natural history the aging, as a biological phenomenon evolutionally evolved among primitive species of Metazoa. An evolutionary design of these species includes a pool of primary totipotent stem cells in the sense of Sköld et al. (138). Primary totipotent stem cells do not have the internal causes for cellular aging. They have two abilities: [I] to generate germ cells (eggs and sperm); [II] and to produce a variety of specialized non-stem cells by an asymmetrical mitosis. The specialized cells are susceptible to the cellular aging and apoptosis due to stochastic causes. These properties of totipotent stem cells gives the primitive Metazoa species a potential immortality as an individual or as a genet (a clone). Equally, they have an ability to agametic cloning. Aging is the programmed phenomenon in the genome that was arose in evolution. The basis of this phenomenon is the principle of the evolutionary damage of both repair and regeneration mechanisms that provide the potential immortality of individuals or genets (clons) of primitive species, as well as to damage the mechanism agametic cloning. These evolutionary damages provide process of aging of individuals by means of stochastic processes. In turn, aging itself dramatically accelerates the rate of evolution and evolutionary success in the long-range outlook.
Keywords: Aging, Metazoa, the third concept of aging
ТРЕТЬЯ КОНЦЕПЦИЯ СТАРЕНИЯ
ВВЕДЕНИЕ
«Per aspera ad astra », говорили древние, так и биогеронтология прошла путь через «тернии» лабораторий средневековых алхимиков и экспедиций китайского императора Цинь Шихуанди за эликсиром молодости; уже виден холодный свет, но до звёзд ещё очень и очень далеко.
Биогеронтология одна из наиболее запутанных областей биологии, которая находится на этапе накопления данных необходимых для теоретических обобщений. Её основа — дихотомия двух конкурирующих между собой концепций старения:
1. Стохастическая концепция: старение — стохастический процесс, результат нарастающего повреждения (изнашивания) структур организма путем самоотравления продуктами жизнедеятельности и/или повреждения, наносимого постоянно действующими факторами среды (74; 72; 86).
2. Концепция программированного старения: старение — результат последовательно развертывающейся программы реализации генетической информации. То есть, старение — результат естественных процессов, так или иначе программированных в геноме.
В целом, это исходные идеи всех так называемых «теорий» старения, коих около 300 включая те которые представляют только исторический интерес (107; 20). Но, ни одна из этих «теорий» не обладает качествами теории, и только некоторые из них можно назвать гипотезами (107; 3).
Стохастическая концепция берет начало из представлений о «жизненной силе », как о главной причине старения, которая присуща всем живым существам и растрачивается со временем. Эти представления основа гипотез «изнашивания» организма от Эмиля Мопы (104) и Рихарда Хертвига (11), полагавших, что организм изнашивается как машина, до современных идей об изнашивании уникальных генов, ферментов, клеток, макромолекул и т.д. как первопричине старения. Например: теория соматических мутаций Оргела (111; 112; 113); гипотеза связывающая старение с мутациями в митохондриальной ДНК (109); гипотеза свободных радикалов Хармана (70); гипотеза поперечных сшивок Бйоксена (38); теломерная теория старения А.М. Оловникова (18, 1971; 110); и т.д.
Концепция программированного старения увидела свет, когда Рассел Валлак (Russell Wallace), выдвинул идею о том, что долголетие, превышающее возраст потомства невыгодно для видов: — «Родители, произведя достаточное количество потомков, становятся помехой для этих потомков, конкурируя с ними за пищу. Естественный отбор выбраковывает родителей и во многих случаях даёт преимущества тем расам, представители которых умирают почти сразу же после того, как произвели потомство».
В 1882 г. Август Вейсман (143; 144) выдвинул гипотезу программированной смерти (ГПС) : существует механизм, возникший путем естественного отбора, для исключения старых изношенных особей и освобождения ресурсов и жизненного пространства в пользу молодых поколений. ГПС сложно верифицировать, ибо Вейсман не предложил эволюционного сценария возникновения возрастного самоуничтожения. Это привело к тому, что в 20м веке ГПС была «опровергнута». Но, слухи об её низвержении оказались прежде-временными (21).
Впервые аргумент против ГПС был изложен в интоксикационной гипотезе старения И.И. Мечникова (108; 17): — представления об «эволюционной тени»: эволюция привела к значительному развитию у Mammalіa толстого кишечника, будучи «заинтересованной» пользой от этого органа и поэтому «пренебрегла» его способностью приносить «гнилостный» вред. При этом селективный «плюс-компонент» предназначается особям молодого и зрелого возраста, а «минус-компонент» адресуется старшим возрастам и является мало реализуемой потенцией, ибо до этих возрастов доживают единичные особи. Другими слова-ми, старость и связанная с нею смерть не имеют места в жизненном цикле многих видов в естественных условиях; для ряда видов — реальны, но не часты. Вследствие этого старшие возрастные периоды спрятаны в «эволюционной тени» и малодоступны для естественного отбора.
С работами Медоуэра (106), Вильямса (145) и Гамильтона (69) посвященным плейотропным генам, представления об «эволюционной тени» И.И. Мечникова, получили вторую жизнь.
Вильямс (145) суммировал аргументы против ГПС: в природе практически все животные умирают в относительно молодом возрасте от случайных причин. То есть если существует механизм программированной смерти, то он не может определять продолжительность жизни (ПЖ) у подавляющего числа особей популяции; поиски механизма программированной смерти успехом не увенчались; трудно представить то, как признак [программа смерти (ПС)] мог бы возникнуть в процессе естественного отбора. Поэтому ряд исследователей, например супруги Л.А. и Н.С. Гавриловы (60), идеи Вейсмана (143) о том, что старение и смерть есть «нечто вторичное, возникшее в процессе адаптации», именуют не иначе как «усопшими».
Как ни странно умозрительная гипотеза одноразового тела , как особый случай антагонистической плейотропии стала одной из доминирующих в биологии старения (87).
В целом, стохастические и «программированные» группы гипотез логически оправданы и имеют в своем арсенале достаточное число фактов, но они диаметрально противоположны: в первом случае старость считается стохастическим процессом, во втором – закономерным процессом. Но, увы, нет объединяющей идеи учитывающей все известные механизмы старения с общей первопричиной.
Начиная с гипотезы Биддера (37) стали появляться идеи, которые выходят за рамки исторически возникшей дихотомии: нейроэндокринная теория старения В. Дильмана; астроцитарная гипотеза старения млекопитающих [АГ] (42; 9); стволовых клеток (СК) гипотеза старения (137; 127) и многие другие.
Назревшая необходимость выдвижения 3-й концепции старения хорошо просматривается на примере АГ (42; 9).
АГ обоснована фактом, что среди всех фил Vertebrata в фетальном и взрослом фенотипах нейробласты мигрируют из зон пролиферации по клеткам радиальной глии (РГ), за исключением Mammalіa, у которых клетки РГ после рождения трансформируется в астроциты, что само по себе запрещает нейротурновер и тем самым инициирует процесс Дильмана . Среди других фил Vertebrata, например, у Aves, сохраняющийся пожизненно нейротурновер не допускает накопления сенильных нейронов, что препятствует развитию процесса Дильмана, поэтому параметры гомеостаза у ряда видов Aves сохраняются пожизненно на одном уровне. Это важный фактор феноменальной ПЖ птиц.
АГ трактует старение особей видов Mammalіa как генетическую болезнь со смертельным исходом, которая обусловлена эволюционным приобретением в тероморфной линии Vertebrata одного признака: трансформации клеток РГ в звездчатые астроциты в течение постнатального онтогенеза. То есть исчезновение эмбриональных радиальных путей миграции нейробластов из пролиферативных зон к местам их конечной локализации в мозгу взрослых особей. Исчезновение РГ запрещает нейротурновер, т.е. замену нейронов — жестко специализированных клеток с ограниченными репаративными возможностями и сроком службы исчерпавших свой жизненный ресурс, что превращает мозг Mammalіa в «постмитотический». С возрастом в результате необратимых патологических изменений в нейронах (и особенно в гормон — синтезирующих) начинает неблагоприятно изменяться уровень гомеостаза организма, что наносит ущерб системам жизнеобеспечения и вызывает смерть. То есть эффекты клеточного старения незаменимых нейронов в Mammalіa переносятся на системный уровень и с возрастом вызывают смерть.
Согласно АГ старение Mammalіa, безусловно, процесс программированный, но программируется не старение как таковое, а программируется запрет на нейротурновер у взрослых особей, что позволяет переносить эффекты клеточного старения нейронов на системный уровень.
Старение нейронов обусловлено действием ряда повреждающих факторов: свободных радикалов, перекиси липидов, ксенобиотиков, альдегидов, изменений рН, температурных повреждений и т.д. В свою очередь, системные факторы, изменяя течение биологических процессов, влияют на темп старения специализированных клеток, в том числе нейронов. Весомый вклад в процесс старения постмитотических клеток вносят свободные радикалы по сценарию Хецера (49) — свободнорадикальное повреждение нуклеопоринов мембраны клеточного ядра, с результатом возрастного изменения спектра экспрессии генов стареющей клетки.
Так как турновер нейронов запрещен, то видоспецифическая максимальная ПЖ (МПЖ), как правило, определяется скоростью метаболизма в организме, о чём свидетельствуют исследования Рубнера и Сейчера (122; 121; 126; 125). В общем, исчезновение РГ индуцирует каскад системных процессов, который назван возраст — зависимым механизмом самоуничтожения Mammalіa.
Возможно АГ является ad hoс гипотезой нейроэндокринной теории старения В. Дильмана (12; 55; 56), которая связывает возрастные изменения чувствительности гипоталамуса к регуляторным сигналам, поступающим от нервной системы и желез внутренней секреции со старением целостного организма. В рамках этой теории АГ указывает на первопричину возрастных эндокринных изменений: перенос эффектов клеточного старения нейронов Mammalіa на системный уровень.
АГ получила ряд существенных подтверждений. Установлено, что значимые параметры гомеостаза странствующего альбатроса (Dіomedea exulans) не изменяются в течение жизни (94), как то и предусматривает АГ.
К какой из ныне существующих концепций старения необходимо относить АГ — вопрос не решённый. Быть может АГ описывает стохастическую реализацию ПС. Термин «стохастическая реализация ПС» встречается в работах В.К. Кольтовера, для обоснования биологического приложения теории надежности с целью интеграции программных и стохастических событий в процессе старения (14; 89; 5). Не исключено, что стохастическая реализация может иметь место.
Термин «генетическая программа» (ГП) широко используется в биологии и медицине, но строгого определения ещё не предложено. Шелдрейк (Rupert Sheldrake) под ним понимает общий план развития организма, основанный на действии единого во всем организме генома, или как целостный план, который реализован на уровне организма (26). Идеи Шелдрейка оценены как псевдонаучные, но его концепция ГП основана на аналогии с программами, определяющими работу компьютеров. Предполагается, что оплодотворенное яйцо содержит программу, которая неким образом определяет морфогенетические за-дачи организма, а также координирует и контролирует его развитие. Однако ГП это нечто большее, чем химическая структура ДНК, ибо идентичные копии ДНК передаются всем клеткам; если бы все клетки были запрограммированы одинаково, они не могли бы развиваться различным образом. Тогда что же такое это нечто? Чтобы ответить на этот вопрос, идею представляют в виде отдельных неопределенных предположений о физико-химических взаимодействиях, каким-то образом структурированных во времени и пространстве; но этот ответ всего лишь иная формулировка проблемы (26).
Другой термин с объяснительной роль как и ГП и используется в том же смысле, — это генотип. Но, Ленартович (96) показал, что если отождествить генотип с молекулой ДНК, то его ценность как средства для объяснения исчезает.
Существует и другое серьезное затруднение. Компьютерная программа продукт разумного существа: — программиста для достижения определенной цели. Если ГП рассматривать как аналог, то тогда должна существовать некая разумно действующая сущность, исполняющая роль программиста. Если предположить, что ГП-мы аналогичны не обычным компьютерным программам, а программам самовоспроизводящихся, самоорганизующихся компьютеров, но таких компьютеров ещё не существует. Если бы даже они существовали, то должны были бы быть невероятно сложным образом запрограммированы теми, кто их изобрел. Выход из этой дилеммы один — утверждать, что ГП продукт эволюции и результат сочетания случайных мутаций и естественного отбора. Но, тогда подобие с компьютерной программой исчезает, и эта аналогия становится бессмысленной. Единственное, что можно констатировать так это то, что ГП действительно существует, но что сие такое или суть этого феномена, современная биология ещё не установила. Свести суть феномена ГП к понятию «ген» или их комбинация — невозможно. Поэтому раз неизвестна суть феномена ГП, то можно обоснованно гипотетизировать, что одна из форм её реализации может быть стохастической.
Пытаясь втиснуть АГ в одну из существующих концепций старения, я провёл целое «расследование» основываясь исключительно на «железобетонные» факты совремённой биологии и биологии старения, в частности. Результат «расследования» вышел далеко за рамки поставленной задачи: — 3-я концепция старения.
ИСХОДНЫЕ ПРЕДПОСЫЛКИ
Данные из области филогенетики и биологии стволовых клеток. Филогенетический анализ ядерных и митохондриальных генов показал, что хоанофлагеллаты (Choanoflagellida) являются ближайшими родственниками Metazoa (124; 51; 85). Принято считать, что некие представители отряда воротничково-жгутиковых (Choanoflagellata) класса биченосцев (Mastigophora) типа простейших (Protozoa) стали родоначальниками первых видов Metazoa. Современных Choanoflagellata нельзя считать прямыми предками Metazoa, ибо у них утрачен мейоз, который демонстрируют все филы Metazoa. Однако не исключено, что когда-то прямые общие предки современных видов Choanoflagellata и Metazoa мало чем отличались от современных Choanoflagellata, ну разве за исключением ряда функций утраченных их современными формами.
Моё «расследование» показало, что в процессе эволюционного возникновения Metazoa возник эволюционный дизайн, который мог демонстрировать потенциальное бессмертие как отдельная особь или как генет.
Эта особенность обусловлена тем, что в момент эволюционного возникновения Metazoa, то есть во время перехода от одноклеточности в многоклеточность, клетки первых примитивных видов Metazoa получили в наследство от одноклеточных предшественников программы возрастзависимого клеточного старения (в том числе теломерно-теломеразный механизм) и программу программируемой клеточной гибели (апоптоз). Но, особенности анцестрального эволюционного дизайна первых видов Metazoa и у ныне живущих примитивных видов Metazoa стоящих у основания эволюционного дерева таковы, что унаследованные от одноклеточных эукариот клеточные механизмы старения, впрочем, как и апоптоз, практически не влияют на ограничение ПЖ этих существ.
Многоклеточность позволила в пределах одного организма разделять те или иные клеточные функции между клетками, что в свою очередь предрасположило путь эволюции, ведущий к специализированным клеточным типам.
Гипотезы посвящённые эволюционному возникновению Metazoa предполагают свой вариант одного и того же сценария: со временем после своего эволюционного возникновения анцестральный многоклеточный организм (Urmetazoan) напоминающий колонию хоанофлагеллат, клетки которого располагались на плоскости, начал эволюционировать. Общий пул клеток разделился на два: пул собственно пролиферативных клеток в смысле СК и пул клеток не способных к пролиферации (пул не стволовых специализированных клеток), который порождался пулом СК.
При этом пул СК в организме Urmetazoan и ныне живущих примитивных видов Metazoa состоит из одного клеточного типа – тотипотентных первичных СК в смысле Скольд с соавт. (138), которые не имеют внутренних причин для клеточного старения и способны генерировать как клетки гермы : [I] яйцеклетки и сперматозоиды (39; 138); [II] так и посредством ассиметричного митоза различные типы не стволовых специализиро-ванных клеток, которые подвержены клеточному старению от стохастических причин и апоптозу. Тотипотентными первичными СК, например, являются археоциты губок, интерстициальные клетки книдарий и необласты Acoelomorpha. Такой же эволюционный дизайн демонстрируют виды сестринских групп общего предка вторичноротых Xenoturbellida (115) и многие другие совремённые филы Metazoa. Как правило, организмы особей видов, которые демонстрируют наличие в своём эволюционном дизайне тотипотентные первичные СК не разделены на сому и герму. В целом пул тотипотентных первичных СК в организме обеспечивает:
потенциал неограниченной регенерации,
способность к бесполому вегетативному размножению,
возможность потенциального бессмертия особи или генета (клона),
Если вид Metazoa способен только к вегетативному бесполому размножению, то возникающие в процессе полового размножения (ПР) геномы можно считать вечными. Потенциальное бессмертие генета обусловлено непрерывным процессом вегетативного бесполого размножения (амплификацией одного и того же генома). У бесполых видов которые возникают однажды из оплодотворённой яйцеклетки (зиготы) в результате мутации приводящей к потере способности к ПР, амплификация одного и того же генома зачастую продолжается в течение миллионов лет. Например, бесполая раса планарий Dugesia tigrina, бесполые виды турбеллярий Stenostomum incaudatum и т.д. Генет, который существует миллионы лет, размножаясь исключительно клонированием, демонстрирует, что совокупный пул тотипотентных первичных СК, который возникает из одной зиготы, не стареет, на фоне того, что отдельные особи ряда бесполых видов могут стареть (102; 100).
Потенциальное бессмертие на уровне особей обусловлено пулом тотипотентных первичных СК и анцестральным эволюционным дизайном Metazoa, который предусматривает тотальный клеточный турновер. Например, планария (Planaria) — одна из фил плоских червей (Platyhelminthes). Эволюционный дизайн этих животных включает необласт — подобную систему СК, которая в принципе является пулом тотипотентных первичных СК и замечательна тем, что она способна генерировать весь спектр клеточных типов сомы и гермы. Необласты сосредоточены по всей мезенхиме в большом количестве и делятся непрерывно, что обеспечивает непрерывный турновер дифференцированных клеток сомы с результатом быстрого самообновления организма животного буквально в течение нескольких недель. Такой эволюционный дизайн позволяет планариям масштабировать размеры тела с сохранением пропорций в зависимости от уровня питания до 50-кратного увеличения или уменьшения размеров тела. При этом они демонстрируют удивительные регенеративные способности, в том числе полную регенерацию тела из мельчайших тканевых остатков: один необласт может заново воссоздать организм планарии (140).
Таким образом, потенциальное бессмертие или пренебрежимое старение особи обеспечивается клеточным турновером специализированных клеток организма путём ассиметричного митоза тех же СК. Действительно, эволюционный дизайн, где каждая СК хорошо защищена от механизмов возрастзависимого клеточного старения, а подверженные клеточному старению специализированные клеточные типы постоянно обновляются, должен обеспечивать потенциальное бессмертие, что и наблюдается в ряде случаев. Яркий пример экземпляр антарктической губки Scolymastra joubini, возраст которой оценивают от 15 до 23 тыс. лет, который был обнаружен на морском дне у побережья Антарктиды (59; 105). Даниэль Мартинез доказал экспериментальным путём выдвинутую ещё в конце XIX века гипотезу о теоретическом бессмертии гидры (101) и т.д.
Но, сия возбуждающая картина потенциального бессмертия, наблюдаемая среди примитивных фил Metazoa в филогенетической линии Bilateria начинает исчезать после прохождения филогенетической точки (назовём её так) Acoela или в память Августа Вейсмана как подтверждение его научной правды — точкой Вейсмана.
Согласно филогенетических исследований Acoelomorpha выделили в отдельный тип (35), как наиболее базальный среди Bilateria находящийся на эволюционном дереве до дивергенции Bilateria на Protostomia и Deuterostomia. По обилию архаичных черт Acoela нет равных.
Так вот, до точки Вейсмана эволюционно возникают в неограниченном количестве виды, состоящие из потенциально бессмертных организмов или генет. А вот после …, таких видов и фил возникает всё меньше и меньше. Видимо потому, что независимо в двух филах Bilateria: Protostomia и Deuterostomia возник новый склонный к старению и возрастзависимой смерти эволюционный дизайн.
Данные из области молекулярной биологии. Ретровирусная революция и эволюция. Генетический код у прокариот и эукариот похож на компьютерные программы записанные в цифровом виде. Генетический код тоже записан в цифровом виде, но на химическом носителе: двухцепочечной молекуле ДНК, которая в неизменном виде передается из поколения в поколение. Но, если у прокариот выход информации от ДНК путём транскрипции в молекулу iРНК и последующей её трансляции в рибосоме в молекулу белка — целиком аналоговый, впрочем, как и регуляция этого процесса, то у эукариот этот процесс несколько отличается. Всё дело в уникальности молекулы РНК.
Действительно, iРНК — точная копия нуклеотидной последовательности ДНК, но только однонитевая с менее жесткой структурой. Молекула РНК, в отличие от линейной строго двухцепочечной ДНК, способна замыкаться сама на себя, приобретая вид 3D-структур, в точном соответствии с цифровой последовательностью оснований, которые часто совпадают со структурой того или иного белка. Таким образом, одна и та же молекула может с одной стороны комплементарно взаимодействовать с ДНК, носителем цифровой информации в клетке, так и, благодаря поверхностным «выступам» и «ямкам», специфически связываться с белками, носителями аналоговой информации.
Комбинирование аналогового и цифрового в одной молекуле по Дж. Маттику, позволяет некодирующим РНК осуществлять регуляцию генной экспрессии. Так, белки-модификаторы, связываясь со структурными мотивами регуляторных РНК по аналоговому принципу, доставляются к строго комплементарному участку ДНК и в составе ДНК-РНК гибрида метилируют ДНК, переписывают гистоновый код или же в составе РНК-РНК гибрида расщепляют белок-кодирующие РНК — феномен, известный под названием РНК-интерференции.
Есть разномыслие об эволюционном возникновении цифрового механизма эукариот. Ряд исследователей полагают, что в эволюционном ряду, от прокариот до эукариот возник качественно иной механизм регуляторных систем клетки, основанный наличием так называемой «битовой строки» у ряда классов РНК молекул клетки. По их мнению, произошёл переход сходный с переходом в современной электронике от аналоговых систем к цифровым. По Маттику (103), сторонника этой точки зрения: — «Тезис, о том, что РНК была из-начальной молекулой жизни, является убедительным, так как молекула РНК имеет свойство с одной стороны быть функциональной молекулой, а с другой стороны быть носителем информации. Нет никаких оснований полагать, что эти свойства были когда-либо потеряны. Кажется, что в начале клеточной эволюции функции РНК как информационного хранилища были переданы ДНК, как более стабильной и легко воспроизводимой молекулы. Фактически, молекулы РНК стали эфемерным промежуточным звеном между жестким диском — ДНК — и аналоговым выходом на, белки. Но я думаю, что позднее в эволюции с началом возникновения сложных организмов РНК повторно вышли на сцену, и стали осуществлять крайне важные регуляторные функции, которые основаны на тех же изначальных свойствах: специфичность к комплементарным последовательностям РНК или ДНК и способность приобретения сложных конформаций, которые взаимодействуют с другими молекулами специфически или динамическим путём».
Познание функций РНК интерференции (или иным термином РНК- сайленсинг), оперирующей на разных уровнях экспрессии генов, показало, что это важнейших механизм процессов развития и дифференцировки у эукариот. Поэтому много внимания уделяется недавно открытому классу малых пиРНК , — эволюционно самой поздней и узкоспециализированной системой РНК- сайленсинга.
Значение системы пиРНК- сайленсинга можно понять приняв во внимание идеи и факты от одного из отцов советского биологического оружия М.В. Супотницкого (23; 24).
Если верить М.В. Супотницкому, то ретровирусная революция отгремела ещё в кембрийские и докембрийские времена, завершившись незадолго до появления первых видов Metazoa. Начался новый этап усложнения генома — ретровирусная эволюция: закрепление отбором механизмов наращивания и усложнения генома мобильными гене-тическими элементами — ретровирусами и ретроэлементами которая не завершилась до сих пор. Её суть в том, что одновременно с образованием новых генетических структур, эндо-генные ретровирусы генерируют образование в геноме других видов ретроэлементов, иг-рающих самостоятельную эволюционную роль: ретротранспозонов и ретропозонов. Общая характерная черта ретроэлементов — закодированная обратная транскриптаза и воз-можность перемещаться по геному хозяина через образование РНК-транскрипта, который транскрибируется «обратно» в ДНК-транскрипт и встраивается в хромосому. Именно этот процесс называют ретровирусной эволюцией. Он создает варианты видов, подвидов, аллелей генов, из которых естественный отбор «выбирает» наиболее приспособленные к данной среде обитания, либо вид, получивший неадаптивный признак, приспосабливается к жизни в той среде, где этот признак становится нейтральным. Причем сами ретровирусы не только творцы этих вариантов, но и фактором естественного отбора. Процесс ретровирусной эволюции М.В. Супотницкий (22) называет «маховиком эволюции».
Вектор эволюции был направлен в сторону усложнения генома, ибо иного пути создания многоклеточного организма, а не рыхлой колонии с ограниченными возможностями просто не существует. Первым шагом к усложнению в эволюции эукариот стал переход от аналоговой записи генетической информации на комбинированный – аналого — цифровой (103). Далее усложнение шло путём совершенствования системы РНК- сайленсинга, который изначально защищал клетку от проникновения вирусов и чужеродной генетической информации, а затем со временем стал использоваться с целью регуляции работы генома. Тем не менее, чего-то не хватало. «Прирученные» ретротранспозоны сохраняли зловредный норов своих предков – ретровирусов. Более того, усложнение генома ведёт к его нестабильности и возможности выведения его из строя. Ретротранспозоны — мобильные элементы, которые являются одним из факторов нестабильности генома, ибо их активация может приводить к множественным разрывам ДНК с последую-щим «летальным», исходом для клетки. Поэтому эволюционно появился новый РНК – игрок в области сайленсинга — пиРНК с функцией подавления активности мигрирующих ретроэлементов. пиРНК были обнаружены у Drosophila melanogaster как комплекс с белками семейства Piwi (146). В целом, это короткие молекулы длиной в 24 — 30 нк, которые ко-дируются в центромерных и теломерных областях хромосомы в обеих цепях ДНК. Нес-мотря на разнообразие пиРНК имеют одну цепь с характерной особенностью — урацил (U) на5’‐ конце и метилированный 3’‐конец. Общеизвестно, что разновидностей пиРНК в том или ином организме может доходить до 500 000. Последовательности пиРНК как правило комплементарны мобильным ретроэлементам, но есть ещё ряд пиРНК комплементарных участкам генов или неким фрагментам генома, функции которых неизвестны.
Данные полученные на эволюционно продвинутых филах Metazoa: Insecta и Mammalia свидетельствовали о том, что гены белков семейства Piwi «включены» исключительно в герме. Также исключительно в герме наблюдалась экспрессия пиРНК. В соме такая активность места не имела (146; 97; 34).
Первоначально считалось, что у Mammalіa пиРНК и белки Piwi имеются только в семенниках (16), но со временем установлено, что особая система пиРНК имеется и в ооцитах Mammalіa (139). Кроме того, при мейозе в ооцитах коровы экспрессируется ген семейства Piwi — PIWI-LIKE 3 (PIWIL3). Но, судя по всему, у Mammalіa Piwi — пиРНК система, функционирует только у самцов (136). У беспозвоночных piРНК были выявлены в герме, как самцов, так и самок (75).
Также Piwi/пиРНК- активность наблюдается на ранних стадиях эмбриогенеза связанная с уничтожение материнских мРНК (120).
пиРНК могут влиять на ретротранспозонную активность через механизм метилирования ДНК и что отключение системы Piwi-пиРНК существенно влияет на степень метилирования ретроэлементов. Но, у Insecta в отличие от Mammalіa метилирование ДНК для регуляции работы генов практически не используется.
Кроме того, пиРНК были обнаружены в нейронах гиппокампа мыши. Вероятно, эти пиРНК участвуют в формировании дендритных шипиков (78).
Ближе к нашим дням появился обвал данных об активности Piwi- пиРНК системы у тотипотентных первичных СК примитивных Metazoa. Джулиано, Ван и Лин (81) со ссылками на ряд источников (33; 54; 57; 133) утверждают, что Piwi — пиРНК система уже была у последнего общего предка всех Bilateria. Этот вывод обоснован тем, что у сестринских Bilateria групп Metazoa Piwi — пиРНК система имеет место.
Система СК губок состоит их двух клеточных тотипотентных типов: археоциты и хоаноциты, у которых Piwi- пиРНК антитранспозонная система пожизненно включена. Также утверждается, что Piwi- пиРНК система позволяет археоцитам и хоаноцитам сохранять тотипотентность (57). Быть может именно она позволяет ряду губок демонстрировать пренебрежимое старение, а одной особи Scolymastra joubini дожить по одним оценкам до 15 тыс. лет, по другим — до 23 тыс. лет (59).
Исследования функционирования геномов Hydra magnipapillata (штамм 105) и Hydra vulgaris (штамм AEP) установлено, что два гена, кодирующих две версии PIWI белков: Hydra PIWI (Hywi) и Hydra PIWI-like (Hyli) экспрессируются во всех типах (!) стволовых клеток гидры, при этом клетки гидры, которые завершили процесс дифференцировки — Piwi белков не экспрессируют (80). В свете этого факта не удивительно, что в 1997 г. Даниэль Мартинес экспериментально доказал выдвинутую в конце XIX века гипотезу о теоретическом бессмертии гидры (101).
В СК гребневика Pleurobrachia pileus также экспрессируется один из паралогов Piwi. Интерес вызывает то обстоятельство, что линии СК гребневика комитированы на генерирование определённых клеточных типов соматических клеток и пространственно разграничены в пределах тела (33).
В целом, пиРНК обнаружены у всех фил Metazoa.
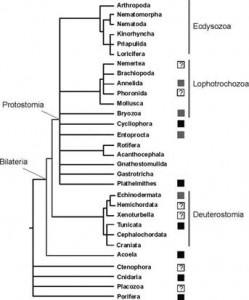
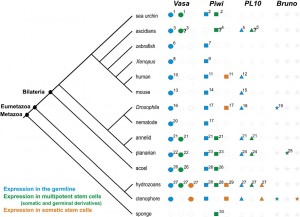
В последнее время была собрана и филогенетически систематизирована информация о наличии или отсутствии тотипотентных первичных СК в эволюционном дизайне среди фил Metazoa (Рис. 1. 138). Также были обобщены данные об экспрессии генов так называемой «стволовости» Piwi, Vasa, PL10, и Bruno в тотипотентных первичных и мультипотентных СК в соме и герме среди видов крупных фил Metazoa (Рис. 2).
Вывод из сопоставления данных суммированных на рис №1 и №2: — виды большинства фил Metazoa в эволюционном дизайне содержат тотипотентные первичные СК экспрессирующие белок Piwi пожизненно; часть из них демонстрируют потенциальное бессмертие как особи или как генеты; способны к вегетативному бесполому размножению.
https://cdn.eto-ya.com/boykoalexey/2014/12/image002.jpg
Рис. 1. Филогенез и способность к вегетативному бесполому размножению среди крупных таксонов (типов) Metazoa. Способность видов (или ряда видов) таксона к вегетативному бесполому размножению отмечена чёрным квадратом, как и то, что эволюционный дизайн взрослых особей этих видов содержит первичные тотипотентные СК, которые активны во время вегетативного бесполого размножения. Серые квадраты также указывают на способность видов (или ряда видов) таксона к вегетативному бесполому размножению и то, что в данном таксоне существуют виды, взрослые особи которых имеют очень гибкую ткань, наблюдаемая в ходе вегетативного бесполого размножения. Ряд таксонов (т.е. кольчатые черви) имеют плюрипотентные СК, на фоне того, что в других группах (мшанки и внутрипорошицевые), взрослые клетки способны развивать более одного зародышевого листка. Вопросительные знаки указывают на группы, где неизвестно, то ли СК взрослых особей или просто рост сомы создаёт и инициирует потенциал для вегетативного бесполого размножения. Адаптировано из Sköld et al., 2009.
Легче перечислить крупные филы Bilateria эволюционный дизайн которых не включает piwi+ необласт-подобные системы тотипотентных СК .
https://cdn.eto-ya.com/boykoalexey/2014/12/image003.jpg
Рис. 2. Обобщенные данные об экспрессии Piwi, Vasa, PL10, и Bruno в тотипотентных первичных и мультипотентных СК и их производных в соме и герме, и строго в СК сомы среди видов крупных фил Metazoa. Диаграмма филогенеза согласно Philippe et al., 2009. Литература: 2. Juliano et al., 2006; 4. Brown et al., 2009; 7. Houwing et al., 2007; 9. Lau et al., 2009; 11. Sharma et al., 2001; 14. Kuramochi-Miyagawa et al., 2001; 17. Cox et al., 2000; 21. Rebscher et al., 2007; 23. De Mulder et al., 2009-b; 26. De Mulder et al., 2009-a; 28. Seipel et al., 2004; 30. Funayama et al., 2010. Адаптировано из Alié et al., 2011.
Среди (Deuterostomia) это:
Cephalochordata — подтип Chordata, который считается наиболее примитивным среди Chordata (ланцетники).
Craniata — подтип Chordata, состоящий из Vertebrata, Petromyzontinae и Myxini.
Среди Protostomia это:
все филы надтипа Ecdysozoa: тип Nematoda; тип Nematomorpha; классы группы Scalidophora: Kinorhyncha, Loricifera, Priapulida; классы типа Arthropoda: Insecta, подтип Crustacea, класс Arachnida и надкласс Myriapoda. [данными относительно типов Cephalorhyncha, Onychophora и Tardigrada автор не располагает].
ряд фил надтипа Lophotrochozoa или Spiralia: тип Mollusca, тип Brachiopoda.
тип Rotifera.
тип Acanthocephala.
тип Gnathostomulida.
тип Gastrotricha.
Таким образом, лишь 6 крупных фил Metazoa не имеют в эволюционном дизайне взрослых особей тотипотентных первичных СК. Но, именно эти филы доминируют среди Metazoa как по суммарному количеству видов живых существ, так и по биомассе. Общей чертой этих фил является разделение анцестрального пула тотипотентных первичных СК на два пула: [I] пул соматических стволовых клеток; [II] пул стволовых клеток гермы.
Проще говоря, произошло разделение сомы от гермы, или как часто пишут – сегрегация гермы. (Впрочем, дубль этого события сейчас происходит среди семейства вольвоксовых (Volvocaceae) из числа растительных жгутиконосцев, род Volvox).
Почему же разделение целостного организма на сому и герму, как правило, характеристика представителей доминирующих и зачастую с очень сложным эволюционным дизайном фил Metazoa?
Прежде чем ответить на этот вопрос необходимо уяснить, что разделение целостного организма на сому и герму представляет собой ни что иное как надёжный механизм старения. Дело в том, что среди видов с сегрегированной гермой производные коммитированных СК сомы как правило обладают сниженной степенью плюрипотентности и способности к самообновлению (32; 118). Также не секрет тот факт, что у видов с сегрегированной гермой СК сомы за рядом исключений тоти- и плюрипотентностью не обладают и, пардон, стареют.
Что же такое произошло в те давние времена первичной дивергенции акоэлопобных предков ныне живущих фил Bilateria, когда столь искусно созданная потенциально бессмертная piwi + необласт-подобная система СК стала покидать эволюционный дизайн ныне наиболее эволюционно успешных фил?
Кажется последнюю точку в ответе на этот вопрос поставила Виктория Луняк (Victoria Lunyak). Собственно говоря, не она, а то открытие, которое совершила руководимая ею группа исследователей, которая показала и доказала, что процесс старения взрослых тканерезидентных СК, ответственных за регенерацию изношенных или поврежденных тканей, может быть повернут вспять. То есть был обнаружен теломеро-независимый механизм клеточного старения СК сомы взрослых особей Mammalia путём сравнения возрастных изменений (141).
Есть мнение о том, что причина репликативного старения клеток (в т.ч. СК) – медленное накопление повреждений молекулами ДНК (127),которое у эукариот ассоциируется с фосфорилированием гистона H2AX, с результатом образования специфической модификации гистона — γH2AX, которая является общепринятым маркером повреждений ДНК. Предпосылкой для изучения механизмов репликативного старения СК для группы В. Луняк стали данные результатов оценки распределения γH2AX в ядрах делящихся одноклеточных грибков Saccharomyces cerevisiae, которое выявило в геноме наличие «хрупких» мест где, наблюдается высокая вероятность повреждения молекул ДНК.
Как модель клеточного старения СК сомы были мультипотентные мезенхимальные стромальные клетки жировой ткани взрослых особей (жММСК) человека, которые в условиях культуры претерпевали в среднем 17 удвоений, после чего постепенно приобретали характерные для репликативного старения признаки. После 37 удвоений подавлялась экспрессия генов, продукты которых участвуют в митозе, а в культуре появлялись гигантские неделящиеся клетки, экспрессирующие ассоциированную с репликативным старением β — галактозидазу (SA-β-Gal). Уровни включения 3[H]-тимидина в ДНК свидетельствовали об очень низком уровне пролиферации на этом этапе.
В клетках есть 3BP1 белок , который обычно локализуется возле разрывов обеих цепей молекулы ДНК. Группа В. Луняк заметила, что в молекулах ДНК у культивируемых жММСК γH2AX и 53BP1, следовательно повреждения в молекулах ДНК распределяются не равномерно, а строго в определённых местах так называемых фокусах. Замечено, на этапе репликативного старения количество клеток с выявленными фокусами повреждений молекул ДНК значительно возрастает. У молодых или самообновляющихся жММСК (SR-MMСК, 19 удвоений) наблюдалось незначительное количество клеток с фокусами повреждений ДНК, на фоне того, что до 90% жММСК имели фокусы повреждений ДНК на этапе репликативного старения (SEN-жMMCK, 37-удвоений).
Известна связь стресс- индуцированного ответа клетки на повреждение спирали ДНК с активацией ретротранспозонов. Так вот, короткие диспергированные повторы в геноме эукариот SINEs , например, Alu повтор , который представлен около 1 млн. копий или около 10,7 % от всего генома человека (123; 25) является самым распространённым. Анализ данных и исследования подсемейств Alu-повторов расширило понимание роли мастер-генов, которые не только ответственны за фенотипические изменения в организме, но и за амплификацию своих ретропозонных копий. Считается, что в геноме многочисленные Alu-повторы являются «продуктом» или «творчеством» мастер-генов. В геноме человека существует, по крайней мере, один активный BC200 РНК мастер-ген — продуцент димерных Alu повторов, известных под названием AluY семейство (15).
Alu-повтор — короткая последовательность ДНК из класса SINEs. Различных типы Alu-повторов — особенность геномов приматов, которые видимо произошли от гена, кодирующего 7SL РНК (91). Ретропозиция Alu-повторов происходит через образование транскрипта РНК-полимеразой III, инсерцию транскрипта и обратную транскрипцию (25). Alu-повторы не кодируют белковых продуктов. Их репликация зависит от LINE ретротранспозонов (90).
Следует отметить, что все семейства SINEs во многом ущербны ибо их ДНК после-довательности не кодируют обратной транскриптазы и их репликация в геноме зависит от репликативных машинерий других мобильных элементов. В данном случае Alu-повторы для размножения используют репликативную машинерию LINE ретротранспозонов , — длинных в несколько тысяч пар оснований последовательностей в молекулах ДНК геномов эукариот. Это полноценные ретротранспозоны без длинных концевых повторов.
Группа В. Луняк обнаружила активацию транскрипции Alu-ретротранспозонов в SEN-жММСК , которая была специфическим событием для репликативного старения, ибо активация транскрипции других генов, обычно транскрибируемых ДНК-полимеразой III, не наблюдалась.
Так как группа В. Луняк применяла 5-Fluorouridine как метку, ей удалось установить, что в фокусах повреждений молекул ДНК у SEN-жММСК, где накапливались 53BP-1 и возникали γH2AX, происходит активная транскрипция генов, производимая ДНК-полимеразой III, ибо её ингибирование предотвращало включение 5-Fluorouridine-метки. Сопоставление полученных данных позволило предположить, что в фокусах повреждений ДНК происходит активная транскрипция Alu-ретротранспозонов.
Был осуществлён полногеномный анализ хроматина жММСК методом иммунопре-ципитации хроматина с антителами к γH2AX-гистонам и последующим секвенированием всего пула выделенных фрагментов на приборе массового параллельного секвенирования ДНК ABI SOLiD (ChIP-seq метод) для точной идентификации геномных локусов молекулы ДНК вовлечённых в процесс репарации. Установлено, что 65% γH2AX-гистонов были связаны с ретроэлементами, преимущественно это были Alu (SINE), L1 (LINE) или LTR ретротранспозонами.
Ранее доминировало мнение, что клеточное старение инициирует укорочение теломер, которое сопровождается накоплением повреждения молекулы ДНК. Этот процесс установлен для процесса старения фибробластов человека (48). Сравнение данных по жММСК полученных на этапе активной репликации с данными на этапе репликативного старения указывало на то, что старение не сопровождается накоплением γH2AX-гистонов в области теломерных областей хромосом. Поэтому группа В. Луняк гипотетизировала, что в отличие от фибробластов, ведущую роль в клеточном старении жММСК и, не исключено других СК человека, играют иные механизмы.
Было известно, что перицентромерные участки 2, 6, 10 и 19 хромосом генома челове-ка высоко обогащены Alu-повторами (130). В свою очередь группа В. Луняк установила тот факт, что на перицентромерных участках хромосом существуют значительные различия в распределении γH2AX-гистонов между реплицирующимися и стареющими жММСК. Значимые различия были обнаружены именно на тех самых высоко обогащенных Alu-повторами перицентромерных участках 2, 6, 10 и 19 хромосом. У SEN-жММСк именно в этих местах происходит аккумуляция γH2AX-гистонов на фоне увеличения тран-скрипции Alu-повторов, что может свидетельствовать только об одном: активность транс-крипции Alu-повторов тесно связана с персистирующими повреждениями ДНК. Этот факт позволил предположить, что активация транскрипции Alu-ретротранспозонов в SEN-жММСК токсична для хроматина и возможно вызывает репликативное старение клеток.
К началу исследований группы В. Луняк уже было известно, что Alu-повторы перицентромерных областей клеток человека связаны с когезином (68) — комплекса белков регулирующего процесс разделения сестринских хроматид в ходе деления клетки, как в про-цессе мейоза, так и митоза. Когезин состоит из четырех частей: Scc1, Scc3, Smc1, Smc3. Белки Smc имеют две главные характеристики: АТФазную активность домена, образующегося при взаимодействии С-конца и N-конца белка и петлеобразную зону, позволяющую димеризацию Smc. Домен АТФазы и петля соединяются между собой через длинную ан-типаралелльную «спираль из спиралей». Общая структура димера имеет центральную пет-лю, окруженную АТФазами. В присутствии АТФ два домена АТФазы могут связываться, формируя структуру кольца. Гидролиз АТФ может вызвать открывание или закрывание кольца.
Scc1 и Scc3 соединяют АТФазные домены Smc1 и Smc3, стабилизируя структуру кольца. N- и C-концы Scc1 соединяются с Smc1 и Smc3. Когда Scc1 соединяется с белком SMC, Scc3 также может присоединиться, соединяясь с С- концевым участком Scc1. Когда Scc1 соединяется и с Smc1, и с Smc3, комплекс когезина формирует закрытую форму кольца. Если же он соединяется только с одним из белков SMC, то образуется структура открытого кольца. Кольца когезина могут димеризироваться, образуя структуру из двух колец, скрепленных частью Scc3 в форме наручников, причем в каждом кольце проходит нить ДНК.
У кольца когезина есть три функции:
1. Удержания сестринских хроматид, соединенных в течение метафазы, гарантируя их соединение в процессе митоза или мейоза. После разделения две хроматиды движутся к противоположным полюсам клетки. Без когезина клетка не смогла бы контролировать изоляцию сестринских хроматид.
2. Облегчает присоединение веретена деления к хромосомам
3. Облегчает восстановление ДНК путем рекомбинации
Ещё не очень понятно, как кольца когезина соединяют сестринские хроматиды. Предполагают два возможных варианта:
1. Части когезина присоединяются к каждой хроматиде и формируют мост между двумя из них.
2. После образования у когезина структуры кольца появляется возможность заключать хроматиды в эти кольца.
Кажется, что, второй вариант более вероятен. Белки, которые необходимы для когезии сестринских хроматид, такие как Smc3 и Scc1, не регулируют образование ковалентных связей между когезином и ДНК, показывая, что взаимодействия с ДНК не достаточно для процесса когезии. Разрушение структуры кольца в когезине через расщепление Smc3 или Scc1 вызывает преждевременную изоляцию сестринских хроматид. Это показывает, что образование кольца когезина важно для выполнения его функций.
Также неизвестно, сколько колец когезина требуется для удержания сестринских хроматид вместе. По одной из версий, одно кольцо окружает хроматиды. Другая версия допускает образование димера, где каждое кольцо окружает одну сестринскую хроматиду. Эти два кольца соединены друг с другом через мост, который удерживает две хроматиды вместе.
Комплекс когезии образуется на начальных этапах S-фазы. Комплексы взаимодействуют с хромосомами перед началом копированием ДНК. Когда клетка начинает дупликацию ДНК, кольца когезина закрываются и соединяют сестринские хроматиды вместе. Комплексы когезина обязательно должны присутствовать в течение S-фазы для того, чтобы когезия имела место. Однако непонятно, как когезин прикрепляется к хромосомам в течение фазы G1. Существуют две конкурирующие гипотезы:
1. АТФазы белков SMC взаимодействуют с ДНК, и это взаимодействие опосредует присоединение колец когезина к хромосомам.
2. Некоторые дополнительные белки помогают процессу загрузки.
Когезин также играет ключевую роль в репарации ДНК, которая осуществляется путём гомологичной рекомбинации и, что дефицит когезина приводит к остановке клеточного цикла в G1 и G2-M контрольных точках (79).
Группа В. Луняк исследовала перемещение частей комплекса когезина к Alu-повторам в перицентромерные области 10-й хромосомы, где были обнаружены кластеры γH2AX-гистонов. В SEN-жММСК нарушалось образования когезиновых комплексов в этих геномных локализациях на фоне того, что в SR-жММСК в этих же местах нарушений не наблюдалось. Это свидетельство о том, что увеличение уровня (точнее количества или концентрации) РНК реплик Alu-повторов нарушает миграцию компонентов когезинового комплекса к Alu-повторам чем препятствует репарации молекул ДНК и, в конечном итоге к накоплению повреждений ДНК в SEN-жММСК.
Группа В. Луняк применяла лентивирусный вектор с геном малой РНК , которая образует шпильку и интерферирует с РНК-репликой Alu-повтора (sh-132Alu РНК). (Точнее sh-132Alu РНК специфически подавляет РНК-реплики Alu-повтора — «искусственный» сайлесинг, фактически, то же самое действие выполняет Piwi – пиРНК антиретротранспозонная система в первичных СК низших метазой или в СК гермы Mammalіa и Insecta).
Трансдукция лентивирусного вектора в SEN-жММСК вызывала изменения морфоло-гии клеток и увеличивала уровень включения 3[H]-тимидина, что сигнализировало об ин-тенсификации процессов пролиферации клеток. В клетках подавлялась экспрессия гена β-галактозидазы и переставали выявляться фокусы повреждений ДНК. Трансфецированные SEN-жММСК активно пролиферировали в культуре в течение периода наблюдения — 40 дней, при этом количество удвоений клеток в среднем достигало 46 раз.
В итоге группа В. Луняк ex vivo продемонстрировала ключевую роль Alu – транскриптов в процессах репликативного старения жММСК человека. То есть показано и тем самым доказано, что клеточное старение является обратимым процессом. Также появился важный и возможно окончательный аргумент в пользу клеточного старения СК сомы взрослых особей Mammalia с человеком, включительно.
Во вторых, в клеточной культуре одного из типов СК сомы взрослых особей человека — жММСК с накопленными токсичными Alu транскриптами группа В. Луняк применяя хитроумные процедуры, сделала то, что при обычных условиях делает Piwi – пиРНК система с вредными для клетки ретротранспозонами, то есть разрушение реплик ретротранспозонов на фоне реювенализации жММСК (141). Возможно, (как я полагаю) сделан очередной, если не самый важный шаг к подтверждению ключевой роли Piwi – пиРНК системы в поддержании потенциального бессмертия пула piwi + необласт-подобных тотипотентных СК низших Metazoa.
Следовательно, стало ясно, почему Piwi – пиРНК система включена в piwi + необласт-подобные системах тотипотентных СК потенциально бессмертных и многих пренебрежимо стареющих организмов и почему стареют особи видов фил с сегрегированной гермой и «одноразовой» сомой у СК которой Piwi – пиРНК система отключена и поэтому эти СК обречены на старение.
В шумеро-вавилонском сказании о Гильгамеше некий Змий при явном попустительстве Богов обрек людей на старость и смерть. Он похитил чудодейственное растение Ур-Эа. Если «перевести» эту сентенцию на современный «биологический язык», то эта мифологическая история недалека от истины. Коварным Змием оказалась эволюция, а волшебным растением — тотипотентные первичные СК.
Злобный демон эволюции разделил у ряда фил Metazoa анцестральный пул первичных СК на два: пул СК сомы и пул СК гермы с последующим отключением, по крайней мере, Piwi – пиРНК антиретротранспозонной системы в линиях пула соматических СК (коммитирование) на фоне того, что Piwi – пиРНК система в пуле СК гермы не отключена. Кажется, сие событие произошло явно всего лишь с одной целью – заново эволюционно «изобрести» механизм собственного возрастзависимого самоуничтожения (возрастзависимый феноптоз – смерть от старения). Особенности такого эволюционного дизайна я предлагаю именовать первым, эволюционно возникшим эшелоном старения у ряда фил Metazoa. Также эти факты подтверждают правоту идей Августа Вейсмана об эволюционном возникновении старения организмов.
Вектор эволюции в натуральной истории Metazoa. «Хоминг» к смерти и старению. Если верить В. Луняк (141) и ещё ряду исследователей, то старение СК сомы обеспечивает генотоксичность ретротранспозонов в силу выключённой пиРНК — Piwi системы этих клеток. Одним словом, пиРНК — Piwi система взрослых особей Mammalіa в полном объеме включена только в герме, ибо согласно эволюционного замысла сома должна стареть и вовремя помирать. А зачем сие необходимо представлено, как критика эволюционной концепции В.П. Щербакова (28; 29), что позволило определить возможные причины эволюционного перехода от потенциального бессмертия представителей первых видов Metazoa к ныне доминирующим смертным формам — или другими словами причину «хоминга» к смерти и старению (7; 8) в эволюционной истории Metazoa.
Становление многоклеточности и обретения потенциального бессмертия изначальными видами Metazoa — это шаг в сторону торможения эволюционного процесса (7; 8), ибо по В.П. Щербакову (28; 29) эволюция — это создание не просто нового, а нового, которое сопротивляется дальнейшим изменениям. Её исход: — виды устойчивые к дальнейшей эволюции. Главный фактор, который сдерживает скорость эволюции — ПР, которое победило потому, что половые популяции более устойчивы к эволюции, чем бесполые и, тем самым, лучше сохраняют свою целостность и конкурентоспособность, даже несмотря на то, что генотипы особей с повышенной конкурентной способностью не сохраняются в следующем поколении, а тасуются в новые комбинации.
Рекомбинация разрушает благоприятные генные сочетания чаще, чем создает их, и поэтому свободно скрещивающиеся популяции с большой численностью эволюционно инертны ибо ПР и когезия создают для популяции антиэволюционный барьер. Главный путь возникновения нового вида требует репродуктивной изоляции небольшой группы особей или всего одной пары. Их потомки обречены на инбридинг, что приводит к сильной гомозиготизации популяции. Гомозиготные особи отличаются пониженной жизнеспособностью вследствие утраты гетерозиготности и обнажения вредных рецессивных аллелей, что, наряду с ещё малой численностью зарождающегося вида и спецификой экологической ниши, в которую попали изоляты, ставит популяцию в критическую ситуацию: элиминируются особи с пониженной жизнеспособностью, но быстро накапливаются мутации, компенсирующие дефектность гомозигот. Через короткое время изолированная популяция (если не вымрет) окажется не похожей на вид, к которому принадлежали изоляты. В этот период быстрой эволюции новые благоприятные мутации быстро закрепляются, но с ростом численности вероятность успешного закрепления новшеств снижается, — скорость эволюции стремится к нулю.
В свете новых фактов к идеям концепции В.П. Щербакова (28; 29) возникает ряд вопросов. Оказалось, что при определенных обстоятельствах исходом эволюции бесполых видов также может быть появление особо устойчивых к дальнейшим эволюционным изменениям видов. Доказано существование в течение десятков миллионов лет партеногенических видов — коловраток класса Bdelloidea (98) и пресноводных ракушковых рачков сем. Darwinulida, потерявших ПР много миллионов лет назад (128); темп молекулярной эволюции ядерных генов у Darwinula stevensoni замедлен примерно в 10 раз в сравнении с другими беспозвоночными (128), ибо предок Darwinula stevensoni, не менее 25 млн. дет назад имел удачный генотип, который обладает широкой нормой реакции и успешно существует в любой среде. Залог эволюционного успеха этого генотипа — генная конверсия и почти полного отсутствия новых мутаций являлось его сохранение не изменённым в течение 25 млн. лет.
Фактически, данный вид перестал эволюционировать, заморозив свою «счастливую» комбинацию аллелей. Другими словами, утрата ПР создала очень устойчивый к дальнейшей эволюции вид (99).
Класс коловраток Bdelloidea радиировал на 360 видов и распространился по всему миру демонстрируя то, что отсутствие рекомбинации не обязательно является эволюционным тупиком.
Есть и другие кандидаты на статус древних бесполых видов.
Например, палочники Timema tahoe и Timema genevievae (131).
В целом, утрата ПР может не препятствует виду быть успешным в эволюционной перспективе. Поэтому эволюционная концепция В.П. Щербакова (28; 29) не решает одну из центральных проблем биологии: эволюционный смысл возникновения пола и его адаптивное значение.
И самое главное В.П. Щербаков (28; 29) отрицает существование механизмов уско-рения эволюции, возникающих в ее ходе. Но, эта точка зрения не учитывает ряд хорошо установленных фундаментальных фактов эволюционной истории. Даже в этом обзоре убедительно показано, что старение среди ряда существующих фил Metazoa возникло путём эволюции изначальных видов Metazoa, склонных к потенциальному бессмертию как особи или генеты.
Значительная часть фил Metazoa эволюционно развившие способность к старению стали доминирующими в Царстве Животных. Филы Metazoa которые в ходе эволюции не смогли «договориться со смертью», и тем самым не сняли эволюционный тормоз предыдущих эпох, и посему не получили значительных преимуществ в «гонке эволюционных инноваций» и поэтому недалеко ушли от основания эволюционного дерева. Правда, некоторые из них дожили до наших дней, сохранили примитивный эволюционный дизайн и доминирующими их в Царстве Животных назвать трудно.
Всё же, я полагаю концепция В.П. Щербакова (28; 29) правильная, но недоработанная. Действительно, с одной стороны ПР в критическую для существования вида ситуацию (бутылочное горлышко) позволяет в отличие от бесполого размножения демонстри-ровать быстрый темп эволюции. Кажется это возможно только при определенных особенностях эволюционного дизайна конкретного вида. Например, трудно представить эволю-цию, если половозрелые особи демонстрируют потенциальное бессмертие, часть из них могут доживать до десятков тысяч лет и к тому же наряду с половым размножением способны к бесполому вегетативному размножению. Особенно с учетом мнения ряда исследователей, что генетическая индивидуальность у клональных Metazoa потенциально бессмертна (58; 77) даже на фоне того, что отдельная особь может стареть (100) ибо в та-ком случае гибель одной особи, зачастую, не уничтожает исходный геном, образовавшийся в результате полового процесса. Вопрос риторический, с какой скоростью будет происходить видообразование у пары репродуктивно изолированных губок Scolymastra joubini с МПЖ в несколько десятков тысяч лет (59) с учётом того что их генетическая индивидуальность потенциально бессмертна ибо губки способны к бесполому вегетативному размножению?
Очевидно, что сочетание вышеупомянутых признаков, скорее, тормозит, чем ускоряет темп эволюции.
Общеизвестно, скорость эволюции — величина пропорциональная трем основным параметрам: коэффициенту отбора, величине популяции и частоте смены поколений (96; 84). Если один из этих параметров — частота смены поколений, не имеет чётко обозначенных временных границ, то темп и скорость эволюции будет резко заторможена для видов, особи или генеты которых демонстрируют потенциальное бессмертие. И наоборот, виды, особи которых демонстрируют чётко обозначенные временные границы ПЖ и размножаются преимущественно только половым путём, то темп смены поколений увеличивается и соответственно темп эволюции. На эволюционном дереве мы наблюдаем, что если виды той или иной филы в своём эволюционном дизайне имеют хотя бы один эволюционный эшелон старения, то такая фила как правило, доминирует, и наоборот если особи видов демонстрируют потенциальное бессмертие, то такие филы, за рядом исключений доминирующими быть не могут.
Есть ещё один аргумент достойный упоминания: есть общеизвестное мнение связывающее резкое ускорение эволюции и видообразования с «изобретением» старения и смерти от старения. Закономерность ускорения темпов эволюции в эволюционной истории была замечена еще в позапрошлом веке: — смена поколений целого ряда групп животных шла более быстрыми темпами ближе к нашей эпохе и была замедленной в эпохи более отдаленные. Один из отцов эволюционной палеонтологии — В.О. Ковалевский в письме к брату от 27 декабря 1871 г. он писал: «Интересен факт ускорения хода жизни, так сказать; от лаурентианской до силгорийской прошло, конечно, больше времени, чем от силюрийской до настоящей эпохи; каждая следующая большая эпоха Земли короче предыдущей, и в это короткое время успевало народиться и вымереть больше разнообразных форм, чем в предыдущую эпоху; начиная от третичной эпохи, жизнь мчится на всех парах: с эоцена большие типы, целые семейства появляются и вымирают и развиваются новые … времени, очевидно, прошло сравнительно немного, а перемена большая: наконец явился человек, совсем овладел миром и дело пошло быстрее» [цит. по Войткевич (10)].
Исходя из квинтэссенции ряда работ Геккеля (63 — 67), опубликованных в 1874-1875 гг., некто Энгельс заметил ускорение темпов развития органического мира в течение геологического времени. «По отношению ко всей истории развития организмов надо принять закон ускорения пропорционально квадрату расстояния во времени от исходного пункта» (31).
Таким образом, ускорение эволюции замечено рядом великих ученых и философов.
Есть ещё один аргумент: — преимущество ПР по сравнению с бесполым в том, что разнообразие генотипов, которые могут создаваться при мейозе, невообразимо велико, причем большая часть этого разнообразия сохраняется в популяции, несмотря на действие естественного отбора (28; 29). Возникает вопрос: почему на столь раннее возникновение и преимущества над бесполым размножением, ПР стало доминирующим только в одном Царстве эукариот – Metazoa?
Ответ видимо в работах Цуя с соавт. (47) по компьютерному моделированию процессов старения где утверждается, что без клеточного старения, эволюционные преимущества ПР не могут быть реализованы среди одноклеточных протист, которые размножаются половым и бесполым способом. Без процесса старения половой процесс бессмысленный даже для одноклеточных эукариот. Более того, ПР у диплоидных форм вряд ли могло утвердиться как распространенный механизм размножения без дополнительного процесса старения (47). Полагаю, что результаты Цуя с соавт. (47) применимы и для видов Metazoa.
Думаю, ПР среди видов Metazoa может демонстрировать преимущества в сравнении с бесполым только при наличии ограничения ПЖ жизни особи (старение), и подавление бесполого размножения. Дополнительным фактором к старению может быть сокращение видоспецифичного дорепродуктивного периода, т.е. увеличение темпов роста и полового созревания. Сочетание ПР и упоминаемых факторов, очевидно, ускоряет темп видообразования.
Поэтому в эволюции произошло то, что должно было произойти. Эволюционно возникли комплементарные процессы позволяющие демонстрировать преимущества ПР в сравнении с бесполым, то есть запрет на бесполое размножение и организменное (системное) старение многоклеточного организма.
Если эти выводы верны и хоминг к старению действительно проявляется в эволюционном процессе, то после эволюционного возникновения первого эшелона старения впоследствии должны были возникнуть и более эффективные механизмы старящие «одноразовую» сому особи. Да, такие феномены возникли и они хорошо известны.
Как введение, я бы хотел обратить внимание на тот факт, что ряд фил Metazoa: Nematoda, Rotifera, Gastrotricha и в определённой степени Insecta (имаго) и т.д., характерны тем, что в их эволюционном дизайне отсутствуют соматические СК. Количество клеток взрослых особей упоминаемых фил, впрочем, как и их судьба, часто фиксируется уже в яйцеклетке или на этапе зиготы. Их клетки изначально генерируются уже в дифференцированном состоянии. Поэтому виды этих фил демонстрируют отсутствие клеточной пластичности и весьма ограниченную регенеративную способность, а также неспособность к вегетативному бесполому размножению.
С возникновением долгоживущих постмитотических клеток в эволюционном дизайне видов Metazoa просматривается постепенное дополнение механизмов первого эшелона старения ещё более эффективными механизмами возрастного самоуничтожения именуемые автором вторым эшелоном старения, которые эволюционно возникали среди различных фил Metazoa, судя по всему неоднократно. В целом просматриваются две схемы второго эшелона старения:
Первая схема. По окончании эмбриогенеза взрослые особи теряют весь пул соматических СК клеток или его значительную часть, а остальные клетки сомы или подавляющая их часть переходят в постмитотическое состояние. Такой эволюционный дизайн характерен, например, для Appendicularia, Nematoda, Rotifera и с оговорками для Insecta. Постмитотичные клетки имеют ограниченные репаративные возможности и ресурс (впрочем, как и все другие специализированные клетки организма, возникающие из СК путем асимметричного митоза). Срок их службы в таком эволюционном дизайне ограничивает ПЖ. Достоинством этого дизайна является почти полная утрата клеточного турновера и следовательно регенеративных потенций, гибель при малейшем физическом повреждении, а также ускоренное старение.
Вторая схема реализована у Mammalia. Эволюционно эта схема старения возникла в результате «модернизации» одного элемента онтогенеза нервной системы Vertebrata: место генерации нейробластов во взрослом и эмбриональном фенотипе и место их конечной локализации разъединены. Во взрослом фенотипе нейробласты мигрируют из вентральной/субвентральной зон по клеткам РГ, но если у всех Vertebrata такая картина сохраняется пожизненно, то у Mammalia РГ вскоре после рождения трансформируется в астроциты, и миграционные пути нейробластов исчезают. Исчезновение РГ индуцирует каскад системных процессов, которые являются ничем иным, как возрастзависимыми механизмами самоуничтожения ибо исчезновение клеток РГ запрещает замену исчерпавших жизненный ресурс нейронов (нейротурновер) — жестко специализированных клеток с ограниченными репаративными возможностями и сроком службы, которые дряхлеют по сценарию Хецера (49) и ещё по неустановленным причинам. По истечении определенного периода, в организме, как результат необратимых патологических изменений в нейронах (и особо — в гормонсинтезирующих), начинает неуклонно и неблагоприятно изменяться уровень гомеостаза, что наносит ущерб системам жизнеобеспечения организма Mammalia, посредством чего прерывается течение его жизни, а МПЖ определяется скоростью метаболизма в организме. Эти факты основа астроцитной гипотезы старения Mammalia (42; 9).
Следует отметить, что если эволюционный дизайн одновременно имеет механизмы первого и второго эшелонов старения то, тем не менее, взрослые особи ряда видов могут демонстрировать уникальное долгожительство, хотя это свойство вовсе не отменяет их старение. Например, максимальная МПЖ основателей колонии термитов Nasutitermes от нескольких десятилетий до 60 лет (6), матка Lasius niger доживает до 28 лет (114) и даже до 211 лет у гренландского кита (Balaena mysticetus) (61) и т.д.
Третий эшелон старения. Половина видов Insecta, (одна из наиболее доминирующих фил Metazoa) на фоне хорошо развитых механизмов первого и второго эшелона старения чуть ли на наших глазах (имеется ввиду геологическое время) формируется третий эшелон старения, наиболее ужесточённая схема ограничения ПЖ.
То есть у ряда групп Insecta дополнительно к сегрегации гермы от сомы и «постмитотического» дизайна имаго, эволюционно возникает аппарат самоуничтожения, который лишает имаго жизни в течение от нескольких часов до недель: – афагия, отсутствие у имаго рта или упрощение пищеварительного тракта, как правило, недоразвит кишечник (119). Можно даже говорить об эволюционном возникновении действительно одноразовой сомы рассчитанной только на один акт размножения, после которого происходит гарантированная смерть.
Часто упоминаемый пример – Подёнки (Ephemeroptera), древний, начиная с девона отряд крылатых Insecta, который насчитывает около 3281 вида, со 157-ми вымершими видами включительно (147). У имаго кишечник на границе средней и задней кишки прерван и заполнен воздухом, челюстной аппарат редуцирован. Имаго подёнок не питаясь, может жить только от нескольких часов до нескольких дней (73). Афагию демонстрируют многие виды отряда Lepidoptera, например, Bombyx mori, имаго которого имеют недоразвитый ротовой аппарат и на протяжении своей жизни не питаются. Также демонстрируют афагию многие виды Coleoptera, например, имаго видов рода Anoxia и рода Prionus (19); ряд семейств двукрылых Insecta под общим названием Oestridae, у которых имаго существует за счёт питательных веществ, которые были накоплены на стадии личинки, поэтому их ПЖ составляет от 3 до 20 дней.
Афагия распространена и среди других отрядов Insecta, например, Plecoptera, Trichoptera и т.д. Возможно, мы имеем дело с афагизацией Insecta.
В ряде случаев афагию демонстрирует только один пол, например, самки ряда видов семейства Elateridae; самцы ряда видов семейства Culicidae и т.д. (44; 41).
В целом, при наличии третьего эшелона старения (афагия) у имаго ряда видов Insecta остаются только функции расселения и размножения, а питание и соответственно рост и накопление питательных веществ происходит только на стадии личинки.
Афагия (следовательно, механизмы третьего эшелона старения) свойственна ряду видов Pisces, например виды рода Oncorhynchus из семейства Salmonidae которые размножаются один раз в жизни, в период нереста не питаются, а после нереста погибают.
В целом, в рамках третьего эшелона старения ПЖ определяется количеством запаса резервных веществ и темпом их использования.
Витаукт. Концепция витаукта (лат. vita — жизнь, auctum – увеличивать) В.В. Фролькиса (30), которая судя по всему проверку временем выдержала, Согласно этой концепции наряду с механизмами старения эволюционно формировались приспособительные, адаптационные возможности организма для сопротивления этому процессу, что предполагает процессы сохраняющих на длительное время жизнеспособность организма: восстановление/репарация биологических структур и компенсация.
По В.В. Фролькису это частные механизмы витаукта определяющие надежность и длительность функционирования клеточных структур, клеток, тканей, органов, систем и в конечном итоге организма в целом. Организм будет сохранять свои адаптационные возможности, пока будут поддерживаться высокий уровень процессов витаукта. Однако когда процессы старения начинают преобладать над процессами витаукта, тогда начинают расстраиваться механизмы витаукта, и как результат бурно прогрессирует возрастная деградация организма. ПЖ организма определяется единством и противоположностью двух процессов — старения и витаукта.
В концепции витаукта есть ряд противоречий с которыми нельзя согласится, например: увеличение ПЖ особи не является целью эволюции, по крайней мере, эволюция человека это утверждение опровергает. Но в целом, иногда это действительно так, как гипотетизирует Фролькис, но в других случаях совершенно иначе.
Впрочем, возникает каверзный вопрос: если увеличение ПЖ особи не является целью эволюции, тогда как эволюционно могли возникнуть механизмы витаукта? Давайте рассмотрим эту проблему в глобальном аспекте.
Группы животных Константа Рубнера
Ru=∫ tmaxtA q(t)dt
Источник
Mammalіa (за рядом исключений) 190 kcal g–1 4
Homo sapiens 665 kcal g–1 126
Неворобьиные виды птиц 602,4 kcal g–1 1
Воробьиные виды птиц 963 kcal g–1 1
Таблица 1. Константа Рубнера для млекопитающих, воробьиных и неворобьиные видов птиц. Частично адаптировано из http://zahav.elementy.ru/genbio/synopsis?artid=189
Константа Рубнера показатель потенциала долгоживучести. Исходя из данных этого обзора ничего странного в том, что МПЖ Aves намного больше (иногда на порядок), чем в Mammalіa сопоставимых размеров, на фоне того, что суммарные затраты энергии (константа Рубнера) в течение жизни в Aves тоже намного выше. Напомню, у Mammalіa два эшелона старения, а у Aves только один (нейротурновер в отличие от Mammalіa имеет место). Но обратите внимание, у одного вида Mammalіa — Homo sapiens непропорциональная величина константы Рубнера. Потенциал долгоживучести Homo sapiens выше чем, например, у совы, но ниже чем у канарейки, не говоря уже о всяких там видах Mammalіa. Думаю, что таким результатам Homo sapiens обязан витаукту.
Согласно гипотезы «эффект бабушки», увеличение ПЖ у Homo sapiens напрямую связано с тем, что у предков Homo sapiens появились заботящиеся о внуках бабушки. Такая забота повышает выживаемость популяции и тому есть доказательства, которые начали появляться ещё в XIX в.: в доисторические времена именно забота пожилых женщин о чужих детях удлинила срок человеческой жизни.
Окончательно эта гипотеза была сформулирована Кристен Хоукс в 2004 году (71).
Рамки статьи не позволяют привести детали и аргументы этой гипотезы, то с ними можно ознакомиться в открытом доступе (13; 62; 83).
Так или иначе, но группе Хоукс удалось показать, что гипотеза «эффект бабушки» справедлива даже для абстрактных моделей, в которых отсутствуют характерные признаки человеческих обществ: семейные пары, орудия труда, охота и большой мозг. По Хоукс: — «Воспитание в среде бабушек сделало нас более зависимыми друг от друга с социальной точки зрения. Эта особенность повлекла за собой появление целого ряда типично человеческих черт, в том числе семейных пар, большого мозга, способности к обучению и склонности к кооперации». Другими словами увеличение мозга стало попутным следствием возросшей ПЖ. Полагаю, что именно это попутное увеличение размеров мозга и привело к увеличению ПЖ.
Есть два аргумента в пользу этого вывода:
Первый аргумент размещён на странице «Регенерация мозга» сайта «Лаборатория инновационных биомедицинских технологий» (Москва) Порядок доступа: www.limbt.com/page/113/ Материал цитируется дословно: «Природа закладывает в развивающийся мозг очень высокий запас надежности: при эмбриогенезе образуется большой избыток нейронов. Почти 70% из них гибнут путем апоптоза еще до рождения ребенка. Человеческий мозг продолжает терять нейроны и после рождения, на протяжении всей жизни. Но более интенсивная потеря нейронов начинается с 30-ого года жизни, когда у человека ежедневно гибнет, не восполняясь, по 30–50 тысяч нервных клеток. Такая утрата структурных элементов мозга генетически запрограммирована. Как следствие, с возрастом уменьшаются основные размеры мозга. Очевидных признаков старения ЦНС мы долго не замечаем за счет пластичности мозга. Биологический смысл пластичности заключается в том, что функции исчезающих нервных клеток берут на себя оставшиеся в живых соседние нейроны, которые могут увеличиваться в размерах и формировать новые синаптические связи. Высокую, но не беспредельную эффективность подобной компенсации можно проиллюстрировать на примере болезни Паркинсона, при которой происходит постепенное отмирание нейронов преимущественно черной субстанции среднего мозга. Оказывается, пока в головном мозге не погибнет около 90% нейронов этой части центра управления движениями, клинические симптомы заболевания (дрожание конечностей, ограничение подвижности, неустойчивая походка и другие) не проявляются, то есть человек может выглядеть почти здоровым».
Второй аргумент. Если жизнеспособность мозга ограничена объемом использованной энергии как это показал Макс Рубнер, то тогда эволюционное модулирование видовой МПЖ, также как и средней видовой ПЖ возможно только двумя путями: снижение метаболической нагрузки, т.е. увеличение массы тела, или многократным дублированием незаменяемых клеток, т.е. увеличение размеров мозга. И действительно, энергетическое правило Рубнера было подтверждено в исследованиях Сейчера на 63 видах Mammalіa, но более строгая зависимость наблюдалась в том случае, если принимался во внимание индекс энцефализации — отношение массы мозга к массе тела в степени 2/3 (126; 125).
Проще говоря, чем больше отношение массы мозга к массе всего тела, тем больше такая особь проживет. У Homo sapiens индекс энцефализации наибольший среди Mammalia и, следовательно, такая же «рекордная» константа Рубнера и как результат до неприличия долгая ПЖ. А виной тому огромный мозг, «бабушкин эффект», так сказать.
Таким образом и судя по всему увеличение объёма мозга в процессе эволюции Homo sapiens является функцией скорее долголетия, чем интеллекта. Вот потому-то мы, люди живём до неприличия слишком долго; по ПЖ Homo sapiens человек среди Mammalia уступает только Balaena mysticetus. Это и называется витауктом – механизмом, который противостоит эволюционным эшелонам старения.
ОБСУЖДЕНИЕ
Думаю, что создание научной строго формализованной теории общей биологического старения невозможно. Ибо изучая и познавая феномен старения, мы имеем дело (в зависимости от религиозных убеждений выбирай нужный термин) с реализованным разумным замыслом Божиим (или эволюционным замыслом) направленным в первую очередь на ускорение темпов эволюции. Но, так или иначе всё равно мы имеем с замыслом. Ряд исследователей выражаются более политкорректно — существуют общие для всех живых существ («публичные») и видоспецифичные («приватные») механизмы старения.
В основу представленных взглядов положен эволюционный принцип, ибо как полагал основатель синтетической теории эволюции киевлянин Феодосий Добржанский : — «Ничто в биологии не имеет смысла, кроме как в свете эволюции». Более точно за основу взята в первую очередь эшелонированность этапов его появления феномена старения в эволюции. Когда я исследовал этот вопрос, у меня сложилось впечатление, что с появлением каждого нового уровня усложнения жизни появляется соответствующий ему тип старения или как я называю – эшелон старения. [В принципе эта работа посвящена не одной, а двум концепциям: — 1. концепция эксклюзивной эшелонированности эволюционных механизмов старения (КЭЭЭМС), которая изложена в предыдущем материале; 2. третья концепция старения, которая формулируется в этом разделе]. В принципе феномен или замысел старения в каждой эволюционной группе живых существ имеет собственные механизмы, обусловленные её эволюционным дизайном той или иной филы. Оперируя изначальными причинами (первопричинами) КЭЭЭМС хороша тем, что позволяет интегрировать мало связанные между собой гипотезы старения. Например, значительный ряд молекулярных, клеточных и физиологических аспектов старения обнаруженных среди эволюционно продвинутых фил Metazoa детерминированы различными формами повреждений и их накопления в молекулах ДНК, клетках, тканях и органах которые в свою очередь преимущественно связаны с реактивными формами кислорода (РФК). Эти процессы центральная тема свободно-радикальной гипотезы (СРГ) старения (70; 40). СРГ имеет огромное число ярых сторонников и столько же ярых противников Хаус (76), например. Появились экспериментальные данные якобы доказывающие отсутствие связи между окислительным стрессом и старением (117). Но, почему-то большинство исследователей обходит тот факт, что свободнорадикальные процессы у особей потенциально бессмертных видов, а также видов демонстрирующих пренебрежимое старение не препятствуют их вечной молодости. Впрочем, те же «молитвы» можно соотносить и к антагонизму между ростом и репродукцией, с одной стороны, и стрессоустойчивостью — с другой; мутациям генов, продукты которых контролируют рост клетки -гормон IGF-1, киназы PI3K и TOR, которые продлевают жизнь эволюционно далеких друг от друга групп животных, но с сегрегированной гермой от Nematoda до Mammalia. Также, в известных мне работах посвящённых долгожительству Aves в сравнении с Mammalia эквивалентной массы. Такое долгожительство наблюдается на фоне того, что у Aves более интенсивный метаболизм (в 1.5 — 2.5 раза), энергозатраты (до 10 раз), температуру тела (на 3°С), чем у Mammalia. Тем не менее, Aves имеют МПЖ в среднем, в три раза (иногда на прядок) дольше (135; 9).
Суммарные затраты энергии у Aves на протяжении жизни на единицу массы намного превышают расчетные согласно энергетического правила поверхности Рубнера (121), даже с учетом поправок Захера (125, 125). Иными словами, в течении жизни Aves продуцируют РФК намного больше Mammalia, но живут намного дольше. Например: МПЖ колибри (вес от 1,5 г), демонстрирующих наивысший уровень метаболизма среди теплокровных позвоночных, достигает у ряда их видов до 15 лет (45). Большинство видов колибри потребляет в день энергии больше, чем среднестатистический человек (36) весом 70-90 кг, при этом продуцируется в 10 раз меньше РФК и Н202, но колибри имеет массу 1.5-3 г! Такой темп метаболизма можно сравнить разве что с горением (9). Столь шокирующие факты вынуждают, адептов одной из двух современных концепций старения, делать ложные выводы. Например о том, что биология старения переживает суровый кризис и медленно развивается через то, что её фундамент состоит преимущественно из эмпирических фактов и плохо проверенных гипотез. В связи с этим В.Н. Анисимов (2) призывает к совершенствованию СРГ. Ужасно то, что другая часть геронтологов признаёт, что вообще не понимает природу старения, но выход из сложившейся ситуации ищет на ойкумене геронтобиологии, выдвигая курьезные проекты, например де Грей (134).
Но «неуниверсальность» СРГ в рамках КЭЭЭМС все противоречия объясняются очень просто становится понятно, как свободно-радикальные процессы у особей потенциально бессмертных видов не препятствуют их вечной молодости, и как у стареющих форм они принимают активное участие в их старении: — если в эволюционном дизайне видов демонстрирующих потенциальное бессмертие в их эволюционный дизайн (I) включен не подверженный клеточному старению пул первичных СК и (II) никоим образом клеточный турновер не ограничен, то с возрастом в организме не будут накапливаться РФК поврежденные специализированные клетки и тем самым сами по себе свободно-радикальные процессы не смогут вызывать старение. Если хотя бы одно из условий не соблюдается то РФК поврежденные специализированные клетки будут накапливаться, а эффект РФК повреждений будет переносится тем или иным путём на системный уровень. В итоге: — старение и смерть организма.
В случае пары долгоживущих Aves в сравнении с Mammalia эквивалентной массы, то долгоживучесть Aves также объясняется весьма просто. В эволюционный дизайн Aves и Mammalia не включен подверженный клеточному старению пул первичных СК, поэтому те и другие рано или поздно стареют, но у Mammalia дополнительно в значительной степени ограничен нейротурновер, поэтому у Aves более долгоживучий организм – то есть у Aves довольно длительный период происходит турновер РФК поврежденные нейронов на ювенальные, что не наблюдается у Mammalia.
Таким образом, без постулатов КЭЭЭМС исследователи не понимали и не будут понимать, при каких условиях свободнорадикальные механизмы «работают» на старение, а при каких нет. (Этот вывод относится и к другим клеточным и организменным процессам, например, апоптоз и т.д. чьё участие в старении организма общепризнанно).
Я полагаю, если создание общей теории биологического старения невозможно исходя из вышеупомянутой причины – в рамках замысла, но не строгой научной теории, то обилие имеющихся идей и фактов в современной биогеронтологии достаточно для построения непротиворечивой эволюционной концепции старения.
Концепция , это некий способ понимания, трактовки каких-либо явлений, основная точка зрения, руководящая идея для их освещения или система взглядов на явления в мире, в природе, ведущий замысел, конструктивный принцип; комплекс взглядов, связанных между собой и вытекающих один из другого, либо система путей решения выбранной задачи. Пожалуй, это вполне возможно. Но, любой концепции необходим основополагающий принцип.
Принцип — это утверждение, которое воспринимается как главное, важное, существенное, непременно или, по крайней мере, желательное. В науке принципы — это общие требования к построению теории, сформулированные как нечто первичное, лежащее в основе определенной совокупности фактов. При характеристике разнообразных систем, принципы отражают те существенные характеристики, которые отвечают за правильное функционирование системы, без которых она бы не выполняла своего назначения.
Точнее, в науке принципами называют общие положения, которым должны удовлетворять научные предположения, гипотезы или теории, например, принцип причинности, принцип эквивалентности, принцип соответствия, принцип неопределенности и т.д. Принципы отличаются от законов природы тем, что их формулировки более общие, менее конкретные. От аксиом принципы отличаются тем, что избираются не произвольно, а формулируются в процессе поиска истины, а поэтому их можно изменять и они могут устаревать. Одновременно принципы часто имеют ограниченные области применимости.
Ну, что ж – используя терминологию далёкую от классической науки, попробую сформулировать принцип 3-й концепции старения – в оккультизме есть такой термин как «порча». Действительно – что есть общего между известными эволюционными эшелонами старения? Только «порча»!!!
В оккультизме порча это некое вредоносное расстройство: болезнь, смерть, психическая неадекватность, уродство, дезорганизация дел и добрых отношений, расторжение договоров, обусловленное магическим влиянием со стороны недоброжелателей, посредством сглаза, или с помощью магического ритуала через пищу, вещи, воду, ветер, дерево и т.д. Если иметь ввиду не оккультизм. А биогеронтологию, то речь идёт не просто о «порче», а порче «идеала», то есть повреждения, искажение чего-то хорошего, лучшего возникшего в эволюции Metazoa.
Причём такая порча запрограммирована в геноме и её результатом является предоставление стохастическим факторам с возрастом особи разрушать или приводить в негодность её целостный организм.
Давайте проанализируем ситуацию в более конкретных аспектах.
1-й эшелон старения. Эволюционно у ряда фил Metazoa происходит разделение анцестрального пула первичных СК на два: пул СК сомы и пул СК гермы с последующим отключением, по крайней мере, Piwi – пиРНК антиретротранспозонной системы в линиях пула соматических СК (коммитирование) на фоне того, что Piwi – пиРНК система в пуле СК гермы не отключена. Как результат в СК сомы возникает генотоксичный ретротранспозонный стохастический фактор , который возрастзависимо приводит в негодность геномы СК сомы. Результат известный – с возрастом возникают проблемы с турновером склонных к старению специализированных не стволовых клеток сомы, эффект передаётся на системный уровень, с результатом — старение и смерть от старения организма (смерть от болезней инициированных старением).
2-й эшелон старения. Программируется невозможность или препятствия турновера постмитотических клеток сомы. Как результат клеточное старение постмитотических клеток сомы от стохастических причин получает возможность переноса на системный уровень, с тем же результатом: старение и смерть от старения организма (смерть от инициированных старением болезней).
3-й эшелон старения. Программируется препятствие для потока материи и энергии в организм из внешних источников (афагия) с результатом быстрой смерти организма от стохастических причин.
ЗАКЛЮЧЕНИЕ
Предложена третья в истории биологии старения концепция феномена старения.
Впервые старение как биологический феномен эволюционно возник среди примитивных видов Metazoa в эволюционный дизайн которых включает пул тотипотентных первичных стволовых клеток смысле Скольд с соавт. (138). Тотипотентные первичные стволовые клетки не имеют внутренних причин для клеточного старения и способны генерировать как клетки гермы: [I] яйцеклетки и сперматозоиды; [II] так и посредством ассиметричного митоза различные типы не стволовых специализированных клеток, которые подвержены клеточному старению от стохастических причин и апоптозу. Эти свойства позволяют примитивным видам Metazoa демонстрировать потенциальное бессмертие как отдельная особь или как генет, а также демонстрировать способность к бесполому вегетативному размножению.
Старение программированный в геноме эволюционно возникший феномен, в основе которого лежит принцип «порчи» ранее возникших в эволюции видов Metazoa механизмов репарации и регенерации, которые обеспечивают потенциальное бессмертие особей или генет примитивных видов, а также механизма бесполого вегетативного размножения, чем в конечном итоге обеспечивается возможность старения особи посредством стохастических процессов. В свою очередь старение как таковое резко ускоряет темп эволюции и эволюционный успех в отдалённой перспективе.
В статье представлены основные постулаты готовящейся к публикации монографии посвящённой 3-й концепции старения.
ЛИТЕРАТУРА
1. Алимов А.Ф., Казанцева Т.И. 2008. Удельный метаболизм, продолжительность жизни и «константа Рубнера» для птиц // Журн. общ. биологии. 69(5): 355 – 363.
2. Анисимов В. Н. 2009. Можно ли получить однозначный ответ на вопрос: существует ли программа старения? // Российский Химический Журнал (ЖРХО им. Д. И. Менделеева). 53(3): 10 — 20.
3. Анисимов В.Н. 2003. Молекулярные и физиологические механизмы старения. СПб.: Наука. 468 с.
4. Аршавский И.А. 1998. Механизм онто- и геронтогенеза у представителей класса млекопитающих // Успехи физиол. наук. 29(4): 93 — 107.
5. Базовский И. 1965. Надежность. Теория и практика. М.: Мир. 373 с.
6. Биология старения. 1982. Серия «Руководство по физиологии». Академия наук СССР. Л.: Наука. 616 с.
7. Бойко А.Г., Лабас Ю.А., Гордеева А.В. 2010. Очерк филогенетической истории феномена старения Metazoa (К вопросу создания общей теории старения Metazoa) // Успехи геронтол. 23: 21 – 29. Порядок доступа: http://www.gerontology.ru/PDF_YG/AG_2010-23-01.pdf
8. Бойко А.Г., Лабас Ю.А., Гордеева А.В. 2009. Очерк филогенетической истории феномена старения Metazoa (К вопросу о ряде доминирующих псевдонаучных концепций в биологии старения) // Успехи геронтол. 22: 588 — 595. Порядок доступа: http://www.gerontology.ru/PDF_YG/AG_2009-22-04.pdf
9. Бойко А.Г. 2007. Дифференцировка клеток радиальной глии в астроциты – вероятный механизм старения млекопитающих // Журн. общ. биологии. 68(1): 35 – 51. Порядок доступа: http://elementy.ru/downloads/elt/o.g.boyko_ageing_mechanism_in_mammals.pdf
10. Войткевич Г.В. 1988. Возникновение и развитие жизни на Земле. (Сер. «Планета Земля и Вселенная»). М.: Наука. 144 с.
11. Гертвиг Р. (Hertwic R.) 1914. О причине смерти.//Новые идеи в биологии. Сборн. третий: Жизнь и бессмертие I. /Под ред. В.А. Вагнера и Е.А. Шульца. СПБ: Образование.- С. 104-135.
12. Дильман В.М. 1958. О возрастном повышении деятельности некоторых гипоталамических центров // Тр. Ин-та физиологии им. И.А.Павлова АН СССР. 7: 326 — 336.
13. Клещенко Е. 2008. Групповой отбор возвращается? // Химия и жизнь» № 5. Порядок доступа: http://elementy.ru/lib/430614?page_design=print
14. Кольтовер В.К. 2009. Теория надежности и старение: стохастическая реализация генетической программы // Проблемы старения и долголетия. 18 (1): 26 – 31. Порядок доступа: http://www.geront.kiev.ua/psid-2010/2009_1.pdf
15. Курышев В. Ю., Брозиус Ю. 2011. Ген BC200 РНК – «живой» мастер-ген отдельного подсемейства мономерных Alu повторов //20-ая междунар. конф. «СПИД, рак и общественное здоровье» 17 — 19 октября 2011 г. Санкт-Петербург. Порядок доступа: http://www.aidsconference.spb.ru/cgi-bin/sort.pl?ses=2&abs=25&year=5&lang=rus
16. Макарова Ю. А., Крамеров Д. А. 2007. Некодирующие РНК // Биохимия.72(11):427 — 1448.
17. Мечников И.И. 1907. Этюды оптимизма. М. Научное слово. 253 с.
18. Оловников A.M. 1971. Принцип маргинотомии в матричном синтезе полинуклеотидов // Докл. АН СССР. 201(6): 1496 — 1499.
19. Плавильщиков Н.Н. 1936. Жуки-дровосеки (Cerambycidae) // Фауна СССР. Жесткокрылые. Т. XXI, часть 1-я. М.-Л.: Изд. Академии наук СССР. 612 с. Порядок доступа: http://www.zin.ru/animalia/coleoptera/pdf/FaunaUSSR_XXI-1.pdf
20. Потапенко А.И., Акифъев А.Л. 2003. На пути поиска программы и инициального субстрата старения // Успехи геронтол. 3:68 — 80. Порядок доступа: http://www.medline.ru/public/art/tom4/art75.phtml
21. Скулачёв В.П. 1999. Феноптоз: запрограммированная смерть организма. // Биохимия. 64(12):1418 — 1426.
22. Супотницкий М.В. 2013. Предвидение Станислава Лема: что сказал и чего не сказал великий писатель о ВИЧ/СПИД-пандемии // Новости медицины и фармации. № 16 (467). Электронный ресурс. Порядок доступа: http://www.mif-ua.com/archive/article/36938
23. Супотницкий М.В. 2007-а. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 1. Генетические паразиты и симбионты генома человека // Энвайронментальная эпидемиология. 1(1): 7 – 58. Порядок доступа: http://supotnitskiy.ru/book/book4-1-1.htm
24. Супотницкий М.В. 2007-б. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 2. Внутриклеточные паразиты и симбионты многоклеточных организмов // Энвайронментальная эпидемиология. 1(2): 183 – 258. Порядок доступа: http://supotnitskiy.ru/book/book4-1-1.htm
25. Хитринская И.Ю., Степанов В.А., Пузырев В.П. 2003. Alu-повторы в геноме человека. // Молекуляр. биология. 37(3):382 — 291.
26. Шелдрейк Р. 2005. Новая наука о жизни. М.: Рипол Классик. 352 с. ISBN: 5-7905-3692-1
27. Шпет Г.И. 1977. Темп роста в онтогенезе представителей древних групп животных / В кн.: Эволюция темпов индивидуального развития животных. М.: Наука. с. 209 — 312.
28. Щербаков В.П. 2005-а. Эволюция как сопротивление энтропии. I. Механизмы видового гомеостаза // Журн. общ. биологии. 66(3): 195 — 211. Порядок доступа: http://evolbiol.ru/scherbakov1.htm
29. Щербаков В.П. 2005-б. Эволюция как сопротивление энтропии. II. Консервативная роль полового размножения // Журн. общ. биологии. 66(4): 300 — 309. Порядок доступа: http://evolbiol.ru/scherbakov2.htm
30. Фролькис В.В. 1970. Регулирование, приспособление и старение. Л.: Наука.
31. Энгельс Ф. 1961. Диалектика природы /в: К. Маркс, Ф. Энгельс. Полн. собр. соч. Т.20. М.: Гос. изд-во полит. лит. С. 610 — 625. Порядок доступа: http://www.kpu.ua/wp-content/uploads/2011/12/t20.pdf
32. Agata K., Nakajima E., Funayama N., Shibata N., Saito Y., Umesono Y. 2006. Two different evolutionary origins of stem cell systems and their molecular basis // Semin. Cell Dev. Biol. 17(4): 503 — 509.
33. Alie A., Leclere L., Jager M., Dayraud C., Chang P., Le Guyader H., Queinnec E., Manuel M. 2011. Somatic stem cells express Piwi and Vasa genes in an adult ctenophore: ancient association of «germline genes» with stemness // Dev Biol. 350(1):183 — 197. doi: 10.1016/j.ydbio.2010.10.019.
34. Aravin A.A., Sachidanandam R., Girard A., Fejes-Toth K., Hannon G.J. 2007. Developmentally Regulated piRNA Clusters Implicate MILI in Transposon Control // Science. 316: 744 — 747. DOI: 10.1126/science.1142612
35. Baguñà J., Riutort M. 2004. Molecular phylogeny of the Platyhelminthes // Can J Zool. 82(2): 168 — 193. doi:10.1139/z03-214
36. Best В. 2006. Mechanisms of Aging. Порядок доступа: www.benbest.com/lifeext/aging.html
37. Bidder G.P. 1932. Senescence // Brit. Med. J. 2: 583 — 585.
38. Bjorksten J. 1968. The crosslinkage theory of aging // J Am Geriatr Soc. 16(4):408 — 427. PMID: 4868749
39. Blackstone N.W., Jasker B.D. 2003. Phylogenetic consideration of clonality, coloniality, and mode of germline development in animals // J. Exp. Zool. 287: 35 — 47.
40. Bonsall M.B. 2006. Longevity and ageing: appraising the evolutionary consequences of growing old // Philos Trans R Soc Lond B Biol Sci. 361(1465): 119 — 135. doi: 10.1098/rstb.2005.1738 PMCID: PMC1626542
41. Bousquet Y. 2014. Family Elateridae. Порядок доступа: http://www.canacoll.org/Coleo/Checklist/PDF%20files/ELATERIDAE.pdf
42. Boyko O.G. 2004. Do mammals die young!? An age-dependent mechanism of mammals self-destruction // Ukr. Bioorg. Acta. 1-2: 3 — 12. Порядок доступа: http://www.bioorganica.org.ua/UBAdenovo/pubs_11-204/Boyko_UBA_11-204.pdf
43. Brown F.D., Keeling E.L., Le A.D., Swalla B.J. 2009. Whole body regeneration in a colonial ascidian, Botrylloides violaceus // J. Exp. Zool. B Mol. Dev. Evol. 312 (8): 885 — 900
44. BugGuide (Сайт). 2014. Identification, Images, & Information For Insects, Spiders & Their Kin For the United States & Canada (bugguide.net). Порядок доступа: http://bugguide.net/node/view/115
45. Calder W.A.I. 1989. Avian longevity and aging // Genetic Effects on Aging II / Ed. Harrison D.E. Caldwell: Telford Press. P. 187-204.
46. Cox D., Chao A., Lin H. 2000. piwi encodes a nucleoplasmic factor whose activity modulates the number and division rate of germline stem cells // Development. 127: 503 – 514
47. Cui Y., Chen R.S. Wong W.H. 2000. The coevolution of cell senescence and diploid sexual reproduction in unicellular organisms // Proc. Natl. Acad. Sci. USA. 97: 3330 — 3335.
48. d’Adda di Fagagna F., Reaper P.M., Clay-Farrace L., Fiegler H., Carr P., Von Zglinicki T., Saretzki G., Carter N.P., Jackson S.P. 2003. A DNA damage checkpoint response in telomere-initiated senescence // Nature. 426:194 — 198.
49. D’Angelo M.A., Raices M., Panowski S.H., Hetzer M.W. 2009. Age-dependent deterioration of nuclear pore complexes causes a loss of nuclear integrity in postmitotic cells // Cell. 136: 284 — 295.
50. Danial N.N., Korsmeyer S.J. 2004. Cell death: critical control points // Cell. 116(2): 205 – 219.
51. Dellaporta S.L., Xu A., Sagasser S., Jakob W., Moreno M.A., Buss L.W., Schierwater B. 2006. Mitochondrial genome of Trichoplax adhaerens supports placozoa as the basal lower metazoan phylum // Proc. Natl. Acad. Sci. USA. 103: 8751 – 8756.
52. De Mulder K., Kuales G., Pfister D., Willems M., Egger B., Salvenmoser W., Thaler M., Gorny A.K., Hrouda M., Borgonie G., Ladurner P. 2009-a. Characterization of the stem cell system of the acoel Isodiametra pulchra // BMC Dev. Biol., 9: 69
53. De Mulder K., Pfister D., Kuales G., Egger B., Salvenmoser W., Willems M., Steger J., Fauster K., Micura R., Borgonie G., Ladurner P. 2009-b.Stem cells are differentially regulated during development, regeneration and homeostasis in flatworms //Dev. Biol., 334: 198 — 212
54. Denker E., Manuel M., Leclère L., Le Guyader H., Rabet N. 2008. Ordered progression of nematogenesis from stem cells through differentiation stages in the tentacle bulb of Clytia hemisphaerica (Hydrozoa, Cnidaria) // Dev Biol. 315(1):99-113. doi: 10.1016/j.ydbio.2007.12.023.
55. Dilman V.M. 1981. The law of deviation of homeostasis and disease of aging. Boston: J. Wright PSG Inc. 380 p.
56. Dilman V. M., Dean W. 1992. The Neuroendocrine Theory of Aging and Degenerative Disease. Pensacola, Florida: Center for Bio-Gerontology.
57. Funayama N., Nakatsukasa M., Mohri K., Masuda Y., Agata K. 2010. Piwi expression in archeocytes and choanocytes in demosponges: insights into the stem cell system in demosponges // Evol. Dev. 12: 275 — 287.
58. Gardner S. N., Mangel M. 1997. When can clonal organism escape senescence? // Amer. Nat. 150(4): 462 — 490.
59. Gatti S. 2002. The role of sponges in high-Antarctic carbon and silicon cycling: a modelling approach // Ber. Polarforsch. Meeresforsch. 434: 1 – 125.
60. Gavrilov L.A., Gavrilova N.S. 2002. Evolutionary Theories of Aging and Longevity //Sci. World J. 2: 339 — 356.
61. George J.C., Bada J. 1999. Age and growth estimates of bowhead whales (Balaena mysticetus) via aspartic acid racemization // Can. J. Zool. 77: 571 — 580.
62. «Grandmas Made Humans Live Longer (Computer Simulation: Chimp Lifespan Evolves into Human Longevity) // New center the University of Utah. Порядок доступа: http://unews.utah.edu/news_releases/grandmas-made-humans-live-longer/»
63. Haeckel E. 1878. Freie Wissenschaft und freie Lehre. Eine Entgegnung auf Rudolf Virchow’s Munchener Rede uber «Die Freiheit der Wissenschaft im modernen Staat». Stuttgart.
64. Haeckel E. 1876. Die Perigenesis der Plastidule oder die Wellenzeugung der Lebenstheilchen. Ein Versuch zur mechanischen Erklarung der elementaren Entwickelungs- Vorgange. Berlin.
65. Haeckel E. 1874. Anthropogenie oder Entwickelungsgeschichte des Menschen. Gemeinverstandliche wissenschaftliche Vortrage uber die Grundzuge der menschlichen Keimesund Stammes-Geschichte. Leipzig,
66. Haeckel E. 1873. Natiche Schopfungsgeschichte. Gemeinverstandliche wissenschaftliche Vortrage uber die Entwickelungslehre im Allgemeinen und diejenige von Darwin, Goethe und Lamarck im Besonderen. Vierte verbesserte Auflage. Berlin.
67. Haeckel E. 1866. Generelle Morphologie der Organismen. Allgemeine Grundzuge der organischen Formen-Wissenschaft, mechanisch begrundet durch die von Charles Darwin reformirte Descendenz-Theorie. Band I: Allgemeine Anatomie der Organismen. Berlin.
68. Hakimi M.A., Bochar D.A., Schmiesing J.A., Dong Y., Barak O.G., Speicher D.W., Yokomori K., Shiekhattar R. 2002. A chromatin remodelling complex that loads cohesin onto human chromosomes // Nature. 418:994 — 998.
69. Hamilton W.D. 1966. The moulding of senescence by natural selection. // J. Theor. Biol. 12:12-45.
70. Harman D. 1956. Aging: a theory based on free radical and radiation biology // J. Gerontol. 11: 298 — 300.
71. Hawkes K. 2004. Human longevity: The grandmother effect // Nature. 428 (6979): 128 — 129. doi:10.1038/428128a. PMID 15014476
72. Hayflick L. 2007. Biological Aging is No Longer an Unresolved Problem // Ann N Y Acad Sci. 1100: 1–13. PMID: 17460161
73. Hoell H.V., Doyen J.T., Purcell A.H. 1998. Introduction to Insect Biology and Diversity. 2nd ed. Oxford University Press. p. 320. ISBN 0-19-510033-6.
74. Holliday R. 2006. Aging is No Longer an Unresolved Problem in biology // Ann N Y Acad Sci. 1067: 1 — 9. PMID: 16803964
75. Houwing S., Kamminga L.M., Berezikov E., Cronembold D., Girard A., van den Elst H., Filippov D.V., Blaser H., Raz E., Moens C.B., Plasterk R.H., Hannon G.J., Draper B.W., Ketting R.F. 2007. A role for Piwi and piRNAs in germ cell maintenance and transposon silencing in zebrafish // Cell. 129(1): 69 — 82.
76. Howes R.M. 2006. The free radical fantasy: a panoply of paradoxes // Ann N Y Acad Sci. 1067: 22 — 26
77. Jackson B.C., Coats A.C. 1986. Life cycles and evolution of clonal (modular) organisms // Phil. Trans. Roy. Soc. London. B. 313: 7 — 22.
78. Ishizu H., Siomi H., Siomi M.C. 2012. Biology of PIWI-interacting RNAs: new insights into biogenesis and function inside and outside of germlines // Genes & development. 26(21): 2361 — 2373. DOI:10.1101/gad.203786.112 PMID 23124062.
79. Jessberger R. 2009. Cohesin’s dual role in the DNA damage response: repair and checkpoint activation // EMBO J 28:2491 — 2493. doi: 10.1038/emboj.2009.217
80. Juliano C.E., Reich A., Liu N., Götzfried J., Zhong M., Uman S., Reenan R.A., Wessel G.M., Steele R.E., Lin H. 2014. PIWI proteins and PIWI-interacting RNAs function in Hydra somatic stem cells // Proc Natl Acad Sci U S A. 111(1):337-42. doi: 10.1073/pnas.1320965111.
81. Juliano C., Wang J., Lin H. 2011. Uniting germline and stem cells: the function of Piwi proteins and the piRNA pathway in diverse organisms // Annu Rev Genet. 45:447 — 469. doi: 10.1146/annurev-genet-110410-132541. PMID: 21942366
82. Juliano C.E., Voronina E., Stack C., Aldrich M., Cameron A.R., Wessel G.M. 2006. Germ line determinants are not localized early in sea urchin development, but do accumulate in the small micromere lineage // Dev. Biol. 300 (1): 406 — 415
83. Kim P.S., Coxworth J.E., Hawkes K. 2012. Increased longevity evolves from grandmothering // Proc Biol Sci. 279(1749):4880 — 4884. doi: 10.1098/rspb.2012.1751.
84. Kimura M. 1983. The Neutral Theory of Molecular Evolution — Cambridge: Cambridge University Press. ISBN 0-521-23109-4.
85. King N., Westbrook M.J., Young S.L., Kuo A., Abedin M., Chapman J., Fairclough S., Hellsten U., Isogai Y., Letunic I., Marr M., Pincus D., Putnam N., Rokas A., Wright K.J., Zuzow R., Dirks W., Good M., Goodstein D., Lemons D., Li W., Lyons J.B., Morris A., Nichols S., Richter D.J., Salamov A., Sequencing J.G., Bork P., Lim W.A., Manning G., Miller W.T., McGinnis W., Shapiro H., Tjian R., Grigoriev I.V., Rokhsar D. 2008. The genome of the choanoflagellate Monosiga brevicollis and the origin of Metazoans // Nature. 451: 783 — 788. PMID:18273011 PMCID: PMC2562698
86. Kirkwood T.B. 2005. Understanding the Odd Science of Aging // Cell 120(4): 437–447. PMID: 15734677
87. Kirkwood T.B.L. 1977. Evolution of ageing // Nature 270: 301 — 304. doi:10.1038/270301a0
88. Kirkwood T.B.L., Cremer T. 1982. Cytogerontology Since 1881: A Reappraisal of August Weismann and a Review of Modern Progress. / Hum Genet. 2nd edn. P. 101 — 121.
89. Kol’tover V.K. 2011. Reliability of electron-transport membranes and the role of oxygen anion-radicals in aging: stochastic modulation of the genetic program // Biophysics. 56(1): 125 — 128. DOI: 10.1134/S0006350911010118 ISSN 000663509
90. Kramerov D.A., Vassetzky N.S. 2005. Short retroposons in eukaryotic genomes. // Int Rev Cytol. 247: 165 — 221.
91. Kriegs J.O., Churakov G., Jurka J., Brosius J., Schmitz J. 2007. Evolutionary history of 7SL RNA-derived SINEs in Supraprimates // Trends Genetics. 23(4): 158 — 161.
92. Kuramochi-Miyagawa S., Kimura T., Yomogida K., Kuroiwa A., Tadokoro Y., Fujita Y., Sato M., Matsuda Y., Nakano T. 2001. Two mouse piwi-related genes: miwi and mili // Mech. Dev., 108 (1–2): 121 – 133
93. Lau N.C., Ohsumi T., Borowsky M., Kingston R.E., Blower M.D. 2009. Systematic and single cell analysis of Xenopus Piwi-interacting RNAs and Xiwi // EMBO J. 28 (19): 2945 — 2958
94. Lecomte V.J., Sorci G., Cornet S., Jaeger A., Faivre B., Arnoux E., Gaillard M., Trouve C., Besson D., Chastel O., Weimerskirch H. 2010. Patterns of aging in the long-lived wandering albatross // Proc Natl Acad Sci USA. 107: 6370 — 6375. doi: 10.1073/pnas.0911181107. PMID: 20308547.
95. Lenartowicz P. 1975. Phenotype-Genotype Dichotomy (in English). Pontif. Univ.Gregoriana, Roma.
96. Lewontin R.C. 1974. The genetic basis of evolutionary change. New York: Columbia University Press. ISBN 0-231-03392-3.
97. Lin H. 2007. piRNAs in the germ line // Science. 316(5823):397.
98. Mark Welch D., Meselson M. 2000. Evidence for the evolution of bdelloid rotifers without sexual reproduction or genetic exchange // Science. 288: 1211-1215. doi:10.1126/science.288.5469.1211
99. Martens K., Rosetti G., Horne D.J. 2003. How ancient are ancient asexuals? // Proc. R. Soc. Lond. B. 270: 723-729.
100. Martinez D.E. 2002. Senescence and rejuvenation in asexual metazoans // In: Reproductive biology of the invertebrates. Vol. 11. Progress in asexual reproduction /Hughes R.N., ed. N. Y.: John Wiley and Sons, P. 115–140.
101. Martinez D.E. 1998. Mortality patterns suggest lack of senescence in hydra // Exp. Gerontol. 33(3): 217 — 225.
102. Martinez D.M., Levinton J.S. 1992. Asexual metazoans undergo senescence // Proc. Natl. Acad. Sci. USA. 89(2): 9920 — 9923.
103. Mattick J. 2010. Video Q&A: Non-coding RNAs and eukaryotic evolution — a personal view // BMC Biology, 8:67 doi:10.1186/1741-7007-8-67 Порядок доступа: http://www.biomedcentral.com/1741-7007/8/67
104. Maupas E. 1888. Recherches experimentales sur la multiplication des infusoires cilies // Arch. Zool. exp. Gen. 6: 165.
105. McClintock J.B., Amsler C.D., Baker B.J., van Soest R.W.M. 2005. Ecology of Antarctic marine sponges: An overview // Int Comp Bio. 45 2: 359 — 368
106. Medawar P.B. 1952. An unsolved problem of biology. L.: H.С Lewis & Co LTD. 217 p.
107. Medvedev Z. 1990. An attempt at a rational classification of theories of ageing // Biol Rev Camb Philos Soc. 65: 375 – 398
108. Metchnikoff E. 1903. Etudes sur la nature humaine: Essai de philosophie optimiste. Paris: Masson & C-ie, 399 p.
109. Miquel J., Economos A.C., Fleming J., Johnson J.E. 1980. Mitochondrial role in cell aging // Exp Gerontol. 15(6): 579 — 591. PMID: 7009178
110. Olovnikov A.M. 1973. A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon // J Theor Biol. 41(1):181 — 190. PMID:4754905
111. Orgel L.E. 1973. Ageing of clones of mammalian cells // Nature 243: 441 — 445.
112. Orgel L.E. 1970. The maintenance of the accuracy of protein synthesis and its relevance to aging: a correction // Proc. Natl. Acad. Sci. USA. 67: 1476.
113. Orgel L.E. 1963. The maintenance of the accuracy of protein synthesis and its relevance to aging // Proc. Natl. Acad. Sci. USA. 49: 517 — 21.
114. Parker J.D., Parker K.M., Sohal B.H., Sohal R.S., Keller L. 2004. Decreased expression of Cu-Zn superoxide dismutase 1 in ants with extreme lifespan // Proc Natl Acad Sci USA. 101:3486-3489
115. Philippe H., Brinkmann H., Copley R.R., Moroz L.L., Nakano H., Poustka A.J., Wallberg A., Peterson K.J., Telford M.J. 2011. Acoelomorph flatworms are deuterostomes related to Xenoturbella // Nature 470 (7333): 255 — 258. doi:10.1038/nature09676. PMID 21307940.
116. Philippe H., Derelle R., Lopez P., Pick K., Borchiellini C., Boury-Esnault N., Vacelet J., Renard E., Houliston E., Quéinnec E., Da Silva C., Wincker P., Le Guyader H., Leys S., Jackson D.J., Schreiber F., Erpenbeck D., Morgenstern B., Wörheide G., Manuel M. 2009. Phylogenomics revives traditional views on deep animal relationships // Curr. Biol. 19: 706 — 712.
117. van Raamsdonk J.M., Hekimi S. 2009. Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans // PLoS Genet. 5(2): e1000361.
118. Rando T.A. 2006. Stem cells, ageing and the quest for immortality // Nature 441:1080 – 1086.
119. Rohdendorf В.В. 1960. Special Characters of Onthogenesis and their Significance in the Insect Evolution // The ontogeny of Insects. Acta symposii de evolutione insectorum/ Praha, 1959. Prague: Publishing hause of the Czecjclovak Academy of Science. P. 56-60.
120. Rouget C., Papin C., Boureux A., Meunier A.C., Franco B., Robine N., Lai E.C., Pelisson A., Simonelig M. 2010. Maternal mRNA deadenylation and decay by the piRNA pathway in the early Drosophila embryo // Nature. 467(7319):1128 — 1132. doi: 10.1038/nature09465.
121. Rubner M. 1908. Das Problem der Lebensdauer und seine Beziehung zu Wachstum und Ernährung. Verlag R. Oldenburg: München, Berlin. 208 S.
122. Rubner M. 1883. Über den einfluss der körpergrösse auf stoff — und kraftwechsel // Zeit. Biol. 19: 536 — 562.
123. Rudin C.M., Thompson C.B. 2001. Transcriptional activation of short interspersed elements by DNA-damaging agents // Genes Chromosomes Cancer. 30:64 — 71.
124. Ruiz-Trillo I., Roger A.J., Burger G., Gray M.W., Lang B.F. 2008. A phylogenomic investigation into the origin of metazoan // Mol Biol Evol. 25(4):664 — 672.
125. Sacher G.A. 1978. Longevity and aging in vertebrate evolution // Bioscience. 28: 497 – 501.
126. Sacher G.A. 1977. Life table modification and life prolongation // Handbook of the Biology of Aging / Eds Finch С, Hayflick L. N.Y.: Reihold. P. 582-638.
127. Sahin E., Depinho R.A. 2010. Linking functional decline of telomeres, mitochondria and stem cells during ageing // Nature. 464:520 – 528. doi:10.1038/nature08982. PMID:20336134.
128. Schön I., Martens K. 2003. No slave to sex // Proc. R. Soc. Lond. B. 270: 827 — 833.
129. Schön I., Martens K., Van Doninck K., Butlin R.G. 2003. Evolution in the slow lane: molecular rates of evolution in sexual and asexual ostracods (Crustacea: Ostracoda). Biological Journal of the Linnean Society. 79: 93-100.
130. Schueler M.G., Sullivan B.A. 2006. Structural and functional dynamics of human centromeric chromatin // Annu Rev Genomics Hum Genet. 7: 301 — 313.
131. Schwander T., Henry L., Crespi B.J. 2011. Molecular evidence for ancient asexuality in timema stick insects // Curr Biol. 21(13):1129 — 1134
132. Sharma A.K., Nelson M.C., Brandt J.E., Wessman M., Mahmud N., Weller K.P., Hoffman R. 2001. Human CD34(+) stem cells express the hiwi gene, a human homologue of the Drosophila gene piwi // Blood. 97 (2): 426 — 434
133. Seipel K., Yanze N., Schmid V. 2004. The germ line and somatic stem cell gene Cniwi in the jellyfish Podocoryne carnea // Int. J. Dev. Biol. 48: 1 — 7.
134. SENS. 2009. A practical approach to developing real anti-aging medicine // Порядок доступа: http://www.sens.org/files/sens/index.htm
135. Severin F.F., Skulachev V.P. 2009. Programmed cell death as a target to interrupt the aging program // Adv Gerontol. 22: 37 – 48
136. Silva R. 2011. Piwi proteins in mammals: a cow’s perspective. Thesis. Lisbon: University of Lisbon. 50 p.
137. Sharpless N.E., DePinho R.A. 2007. How stem cells age and why this makes us grow old // Nat Rev Mol Cell Biol. 8:703 — 713. doi:10.1038/nrm2241
138. Sköld H.N., Obst M., Sköld M., Åkesson B. 2009. Stem cells in asexual reproduction of marine invertebrates / Stem cells in marine organisms / Eds. Rinkevich B., Matrannga V. Dordrecht, Heidelberg, London, New York: Springer. doi: 10.1007/978-90-481-2767-2
139. Tam O.H., Aravin A.A., Stein P., Girard A., Murchison E.P., Cheloufi S., Hodges E., Anger M., Sachidanandam R., Schultz R.M., Hannon G.J. 2008. Pseudogene-derived small interfering RNAs regulate gene expression in mouse oocytes // Nature. 453(7194): 534 — 538. doi:10.1038/nature06904. PMID 18404147.
140. Wagner D.E., Wang I.E., Reddien P.W. 2011. Clonogenic Neoblasts Are Pluripotent Adult Stem Cells That Underlie Planarian Regeneration // Science. 332(6031): 811 – 816. doi: 10.1126/science.1203983
141. Wang J., Geesman G.J., Hostikka S.L., Atallah M., Blackwell B., Lee E., Cook P.J., Pasaniuc B., Shariat G., Halperin E., Dobke M., Rosenfeld M.G., Jordan I.K., Lunyak V.V. 2011. Inhibition of activated pericentromeric SINE/Alu repeat transcription in senescent human adult stem cells reinstates self-renewal // Cell Cycle. 10(17):3016-30.
142. Weismann A. 1891. in Weismann on Heredity / (eds Poulton E. B., Schönland S. & Shipley A. E.). 2nd edn. Oxford: Oxford University Press. P. 23 – 24.
143. Weismann A. 1889. The significance of sexual reproduction in the theory of natural selection // Essays upon heredity and kindred biological problems. Oxford: Clarendon Press. P. 251–332.
144. Weismann A. 1882. Über die Dauer des Lebens. Verlag von Gustav Fisher, Jena, Germany.
145. Williams G.C. 1957. Pleiotropy, natural selection, and the evolution of senescence // Evolution 11: 398 — 411
146. Vagin V.V., Sigova A., Li C., Seitz H., Gvozdev V., Zamore P.D. 2006. A distinct small RNA pathway silences selfish genetic elements in the germline // Science. 313(5785): 320 — 324. DOI:10.1126/science.1129333
147. Zhang Z-Q. 2013. Phylum Arthropoda // Zootaxa 3703 (1): 17 – 26. Порядок доступа http://www.mapress.com/zootaxa/2013/f/zt03703p026.pdf